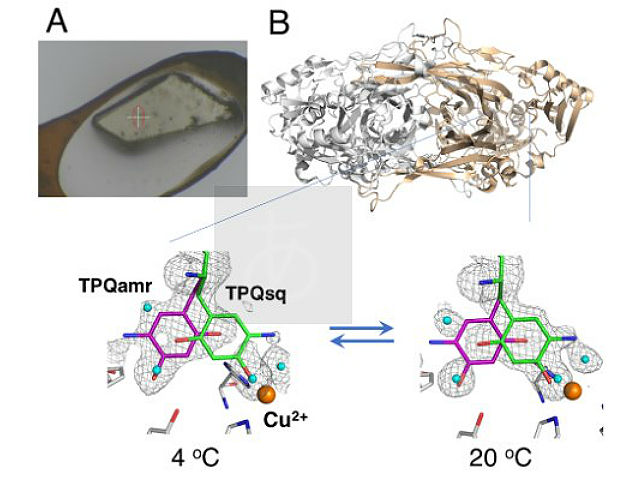
大阪大学,大阪医科大学,高輝度光科学研究センター(JASRI),理化学研究所らは,銅アミン酸化酵素の触媒反応の際に起こる構造変化を,大型放射光施設「SPring-8」のBL38B1での実験により精密に解析することに成功した(ニュースリリース)。
銅アミン酸化酵素は,様々な生物種に幅広く存在する酵素タンパク質であり,一級アミン類をアルデヒドとアンモニアに分解する活性を持っている。その活性中心には,銅イオンと補酵素トパキノンを含んでおり,ヒトの血清中の本酵素は,糖尿病の発症にも関与している。
タンパク質のX線結晶構造解析は,強力なX線で結晶が損傷を受けることを防ぐために,通常-170℃付近の極低温で凍結結晶を用いて行なわれる。得られる構造は,実際のタンパク質が機能する20℃付近での立体構造とは基本的に変わらないが,凍結した際に室温でとりうる多彩な構造のいくつかが失われてしまい,タンパク質が実際にどのように働くかということを説明できなくなることが指摘されていた。
凍結していない結晶のX線回折測定は,これまで石英チューブの中に結晶を封じ込めることによって行なわれてきた。しかし,この方法では測定時の温度を厳密に制御することができないという問題があった。
今回研究グループは,結晶をむきだしに近い状態のまま安定に保つことのできるHumidairandglue-coatingmethod(HAG法)を用いることによって,厳密な温度,湿度,およびpH条件が設定された非凍結結晶のX線結晶構造解析を行ない,タンパク質の立体構造とその変化を詳細に決定することを実現した。
この研究で結晶の温度を変化させることにより,構造変化にともなう熱の出入り(エンタルピー変化)やミクロの乱雑さの変化(エントロピー変化)といった熱力学的測定を世界で初めてタンパク質結晶のまま行なうことができた。さらにこのような熱力学的解析から,結晶内でのタンパク質の動きは,希薄な水溶液中よりも,多くのタンパク質が高濃度で存在する細胞内の状態に近いことがわかった。
研究グループは,今回の研究により,各種タンパク質の機能を立体構造や平衡状態の変化をもとに解明し,有用酵素の作製や酵素を阻害する薬剤の開発などにも役立たせることが期待できるとしている。