 愛媛大学,高知大学,筑波大学,日本電子は,アルツハイマー病などの原因とされるアミロイドの毒性機構の一端を,最先端顕微鏡技術による研究で明らかにした(ニュースリリース)。
愛媛大学,高知大学,筑波大学,日本電子は,アルツハイマー病などの原因とされるアミロイドの毒性機構の一端を,最先端顕微鏡技術による研究で明らかにした(ニュースリリース)。
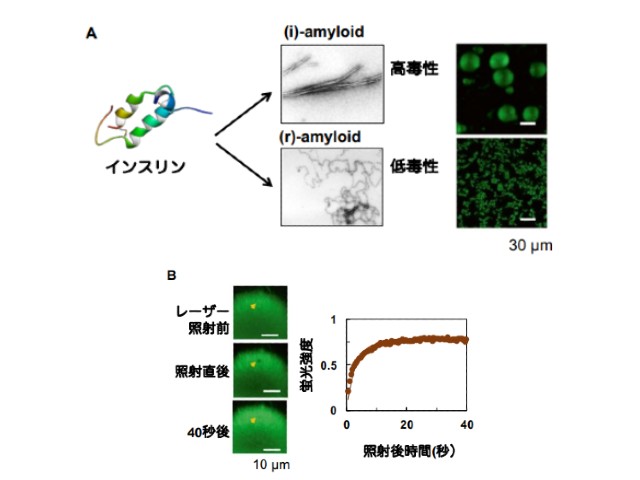
アミロイドは,構造がこわれたタンパク質が自己集合する事によって形成されるタンパク質凝集体であり,アルツハイマー病(AD)など様々な疾病の原因になっている。アミロイドを形成しやすいタンパク質の一つにインスリンがあり,アミロイドモデルとしてよく用いられている。
これまでに研究グループは,インスリンが毒性や構造の異なる2種のアミロイドを形成することを明らかにしてきた。今回,同じタンパク質から形成される,これら二つのアミロイド形成について検討し,アミロイド毒性の謎に迫った。
まず,アミロイドの毒性と液液相分離現象の関連を調べた。液液相分離(LLPS)は,タンパク質が集合し,液滴を形成する現象を示す。液滴内ではタンパク質が高濃度で存在しており,近年,生体内での重要な生命現象(遺伝子転写,タンパク質への翻訳など)において重要な役割を果たすことが明らかになっている。また,液滴内ではアミロイドの形成が行なわれている事も示されている。
研究では,毒性の異なる2種のインスリンアミロイド((i)-amyloid(高毒性),(r)-amyloid(低毒性))形成過程に液液相分離が関連しうるかを調べた結果,毒性が高(i)-amyloidにおいてのみ,30μm程度の大きさの円形の構造体が観察された。
最先端顕微鏡技術を用いたFRAP(光褪色後蛍光回復法)実験を行なったところ,内部は流動的であり,液液相分離現象による液滴が形成していることが分かった。低毒性の(r)-amyloidでは液滴が形成しなかったことから,アミロイドの毒性と相分離現象に関連があることが分かった。
さらにアミロイド形成における静電相互作用の影響を評価するために,塩の効果を調べた。塩は,分子間の静電相互作用の弱める作用があり,塩によりアミロイド形成が阻害されれば,静電相互作用が重要であることを示すことになる。
その結果,高毒性の(i)-amyloid に関して,より塩の効果が顕著で,(r)-amyloid ではその効果はほとんどなかった。これらの結果は,液液相分離現象を示した高毒性の(i)-amyloid形成において,静電相互作用が重要であることを示している。
研究では,疎水相互作用の影響の評価も行なったが,2種のアミロイドにおいて差異はみられなかった。この手法では,相互作用を明らかにするために添加剤を用いると同時に,相互作用を制御するというアプローチをとっており,研究グループは,様々な研究に応用可能だとしている。