北海道大学の研究グループは,タンパク質を超高感度で検出する技術を開発した(ニュースリリース)。
ナノメートルサイズの金属構造体を利用して,物質の化学構造に特有のシグナルであるラマン散乱を増強し,分子を同定する表面増強ラマン散乱法では,金属ナノ構造体のナノサイズの狭い隙間に入り込んだ分子から発生するシグナルが最も強く,これによって微量分子の高感度検出が可能になる。
しかし,サイズが大きなタンパク質のような生体高分子を狭い隙間に効率的に導入することが困難だった。
研究グループではこれまで,金ナノ粒子の自己組織化膜とハイドロゲルを複合化することで,ナノ粒子集合化膜の粒子間距離を動的に制御するシステムを開発し,表面増強ラマン散乱の高感度検出法の開発に取り組んできた。
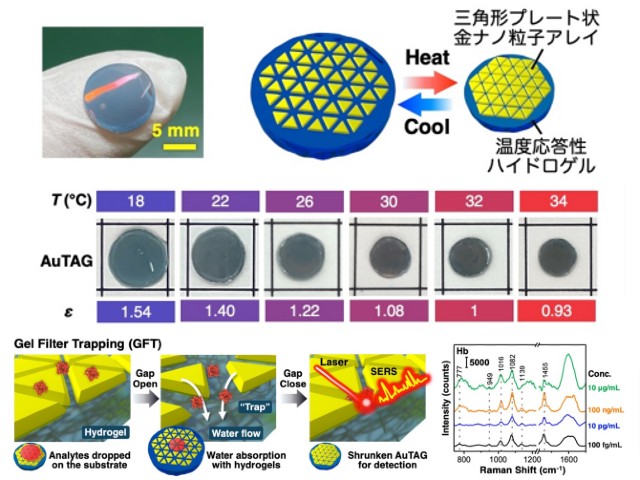
今回,まずナノ粒子の構造の最適化を行ない,より高い増強電場の形成を可能にした。具体的には,三角形プレート状粒子を合成し,表面修飾を施した後,水面上で自己組織化膜を形成させ,固体基板上に移し取った。
その結果,三角形ナノ粒子が高密度にきれいに並んだものが得られた。この構造は,三角形の頂点が集まる部分に空隙を形成する。また,電磁場計算により,この頂点が集まった部位で非常に強い増強電場が得られることも確認した。
この数nmの空隙にタンパク質を導入することができれば,高感度なタンパク質の検出が可能になる。そこで,この狭い空隙に効率的にタンパク質を導入するための手法(ゲルフィルタートラップ法)を開発した。
具体的には,得られたナノ粒子膜を温度に応答して大きさが変わるハイドロゲルの上に載せた。ハイドロゲルの大きさが変わるとき,ゲルは水を吸い込んだり吐き出したりする。その吸水する力を利用して,タンパク質を粒子の間に引き込んだ。
ゲルは網目構造を有しているため,吸い寄せられたタンパク質はゲルの表面で捕捉される。その後,ゲルを縮めて粒子間距離を狭め,ラマン散乱測定を行なった。その結果,1 滴以下(15µL)の量の様々なタンパク質溶液から,それぞれの分子に依存したラマンシグナルを高感度に得ることに成功した。
pg/mLの超希薄な濃度では,測定領域にタンパク質が1分子あるかないかという条件になり,1分子のタンパク質からシグナルを検出することもできることを確認した。また,ハンディタイプの検出器でも十分な検出が可能なことも確認した。
この結果から,すべての生体高分子を簡便かつ高感度に検出可能なシステムになることが想定されることから,研究グループは,バイオマーカーの検出システムへの応用が期待されるとしている。