 三重大学の研究グループは,ゼブラフィシュの初期胚(受精から数時間後の胚)において,深紫外線LED(UVC-LED;278nm)を直接照射した場合の安全な照射量と,紫外線によるDNA損傷を修復する分子メカニズムを解明した(ニュースリリース)。
三重大学の研究グループは,ゼブラフィシュの初期胚(受精から数時間後の胚)において,深紫外線LED(UVC-LED;278nm)を直接照射した場合の安全な照射量と,紫外線によるDNA損傷を修復する分子メカニズムを解明した(ニュースリリース)。
260nm前後のUVCは,細菌やウイルスのDNA損傷を誘発し,不活化させるため,殺菌を目的として利用されている。
特に,240nm以下の波長(207nm,222nm,233nm)のUVCが新型コロナウイルスを死滅させ,なおかつ病変を引き起こさないという研究に注目が集まっている。しかし,280nmのUVCの毒性,安全性,および照射に対する生体の反応に関する評価報告はほとんどなかった。
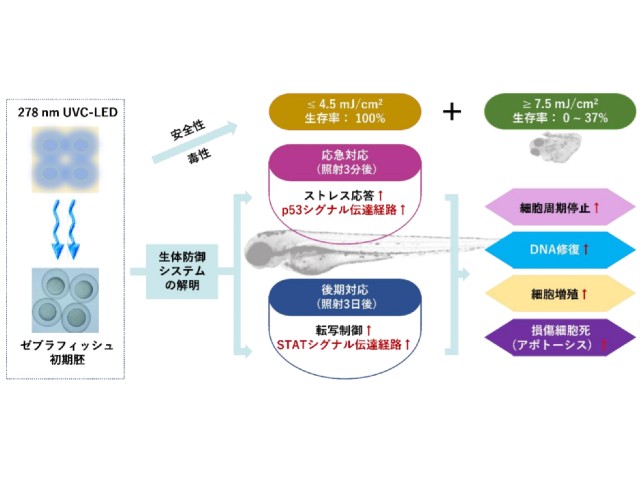
今回,研究グループらが開発した278nmのUVCを照射するLED装置(UVC-LED)を用いて,照射量を0.5~60mJ/cm2 の範囲で計16種類設定し,受精後5~6時間のゼブラフィッシュ胚に直接照射した。
照射3日後のゼブラフィッシュ胚の生存率,孵化率,心拍数,奇形率など評価した結果,4.5mJ/cm2以下の照射量ではすべての胚が生存していた。しかし,7.5mJ/cm2 では,奇形率が82%まで著しく増加するとともに,生存率も37%まで低下し,さらに10mJ/cm2以上では,胚が全滅することが判明した。
これらの結果により,UVC照射によるダメージに対し,ゼブラフィッシュ胚の内部生体防御システムが最大限に稼働できる限界線量は,4.5mJ/cm2であると判断した。
更に,UVCで生じるDNA損傷に対し,ゼブラフィッシュの生体防御メカニズムを解明するため,4.5mJ/cm2の照射量で処理したゼブラフィッシュ胚を対象に,次世代シーケンサーを用いたトランスクリプトーム解析を行なった。
それによれば,UVC照射直後には,p53シグナル伝達経路が緊急に活性化され,細胞周期の停止,DNA修復,細胞分裂・増殖,損傷した細胞の死を促進するなど速やかにストレスに応答することが確認できた。また,3日間の回復後には,p53の変動が弱まり,代わってSTATシグナル伝達経路が活性化し,引き続きDNA損傷を修復するメカニズムを明らかにすることができた。
研究グループは,この成果がヒトに対するUVCの応用における安全性について科学的な根拠を提供すると同時に,コロナウイルスを含むウイルスや細菌の殺菌,水産物養殖時の消毒など,幅広い領域でのUVCの活用に役立つ可能性があるとしている。