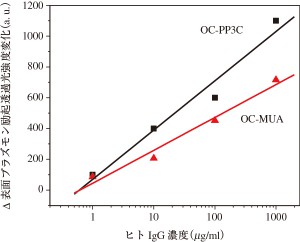
次に,PP3C電解重合膜を用いた場合のヒトIgG検出感度について,一般的に用いられているメルカプトウンデカン酸(MUA)自己組織化膜をPP3Cと同様の方法で抗ヒトIgGを固定化した場合と比較した。図5に1~103 μg/mlの濃度でヒトIgGをPBS中に注入し透過型表面プラズモン共鳴センシングを行った場合の強度変化を示す。
いずれの場合も濃度変化に対してリニアに光強度が変化していることが分かった。また,PP3C電解重合膜を用いた方がMUAの場合よりも感度が良いことが分かる。これは,電解重合膜の荒さや膜内部のカルボキシル基も活性化されたために,特異吸着部位が増加ことによると考えられた。
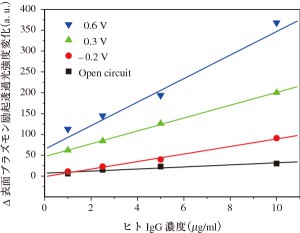
さらに,検出感度を高めるためにPP3C薄膜の電気化学的制御を試みた。図6に,金グレーティング電極/PP3C薄膜の電位を–0.2,0.3と0.6 V,さらに自然電位(OCP)一定にしてヒトIgGを検出した場合の表面プラズモン共鳴透過光強度変化の濃度依存特性を示す。図に示すように電位の上昇に伴っ表面プラズモン透過光強度変化が強くなることが分かった。
これは,電位の増加にともなってPP3C薄膜が軽いドープ状態となることで膜が膨らみ,膜内の空間が増えることでヒトIgGが特異吸着できる部位,抗ヒトIgG部位が増加したことが原因と考えられる。すわなち,電位を制御することで吸着部位を開いたり閉じたり制御することも可能であることを示唆している。
4. まとめ
本稿では,電気化学測定と組み合わせた透過型表面プラズモン共鳴特性の導電性高分子のドーピング状態変化による制御,透過型表面プラズモン共鳴法によるバイオセンサーについて紹介した。機能性導電性高分子薄膜を用いて電気化学的に制御することで感度の上昇が得られることを示した。特に透過型表面プラズモン共鳴バイオセンサーは簡易・安価であり,今後バイオセンサーを始め様々な分野において簡便なセンサー・デバイスとして非常に有望であると考える。