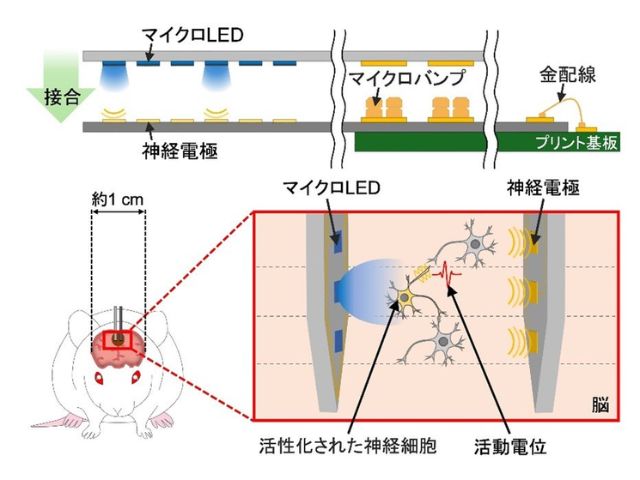
東京大学の研究グループは,生物の神経活動を光で操作する光遺伝学の中心的な分子ツールである,チャネルロドプシンのチャネル開閉メカニズムを解明することに成功した(ニュースリリース)。
東京大学の研究グループは,生物の神経活動を光で操作する光遺伝学の中心的な分子ツールである,チャネルロドプシンのチャネル開閉メカニズムを解明することに成功した(ニュースリリース)。
チャネルロドプシン(ChR)は7本のαヘリックスと,色素分子であるレチナールから構成される膜タンパク質であり,光受容型イオンチャネルとして機能する。
ChRは,光によって神経細胞の活動を制御する光遺伝学(オプトジェネティクス)の中心的なツールであり,神経科学や脳神経疾患の治療法開発に欠かせない。しかし,ChRのチャネル開閉メカニズムが不明なためイオン輸送特性の改良が十分に進まず,適応範囲が限られていた。
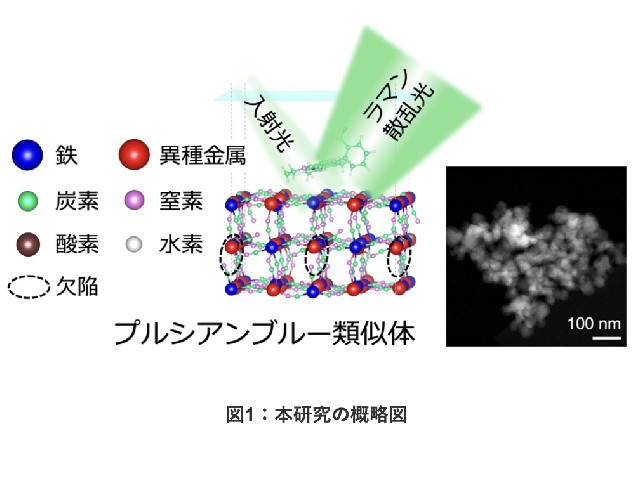
開閉メカニズムの解明にはChRの構造情報が必要となる。ChRの構造測定は,代表的なChRであるC1C2を対象にX線結晶構造解析が進められており,2012年には光吸収前における始状態構造が,2021年にはチャネル開口直前の状態おける構造が報告されている。
一方,X線結晶構造解析では,結晶化に伴うタンパク質のパッキングが原因でチャネルが開かないため,最も重要なチャネル開口時や,それ以降の過程における構造は不明だった。
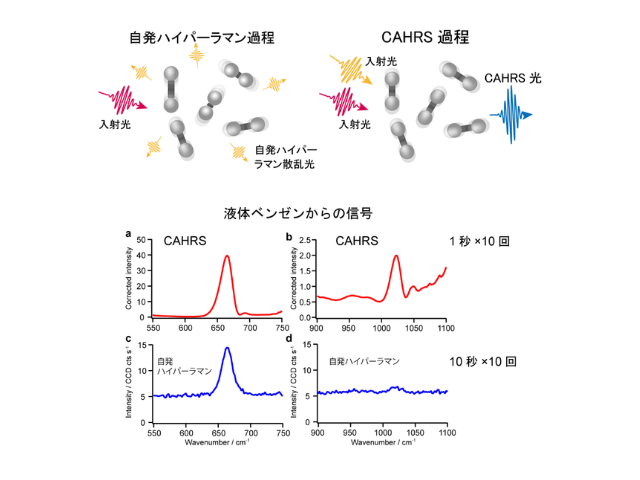
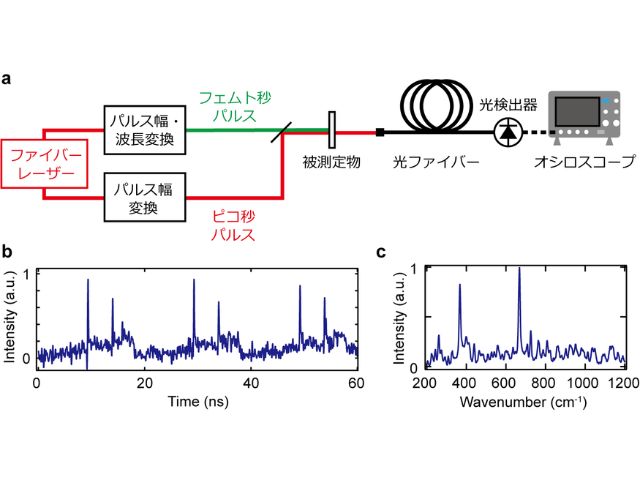
ラマン分光法は,生理的な温度の水溶液中におけるタンパク質の構造を測定できる。そこで研究グループは,大量発現が困難であり,室温での変性が早いC1C2のラマンスペクトルを取得すべく,5nmolかつ90分でスペクトルを取得できる光学系を開発した。
この光学系を用いてC1C2の構造を測定した結果,チャネル開口時にレチナールが大きくねじれることが明らかになった。また,構造情報と電気生理,過渡吸収測定の結果を組み合わせることで,
①:レチナールがねじれることで周囲のヘリックスが押し出され,チャネルが開く
②:イオン輸送経路は,レチナールとタンパク質を結ぶシッフ塩基結合を通過するように形成される
③:タンパク質外から流入した水分子を経由して,プロトンがシッフ塩基へと移動する
④:シッフ塩基がプロトン化するとレチナールのねじれが緩和し,チャネルが閉じる
⑤:チャネルが閉じる速度は,シッフ塩基のプロトン化速度によって決定されている
という,C1C2の詳細なチャネル開閉メカニズムの解明に成功した。
このメカニズムに基づけば,レチナール周辺のアミノ酸に変異を加えることでイオン輸送量を増やすことや,レチナールシッフ塩基のプロトン化速度を最適化することで,高速に開閉するChRの開発が期待される。
研究グループはこの成果について,光受容型イオンチャネルに関する理解を進めただけでなく,次世代型の光遺伝学ツールの開発指針を与えるものだとしている。