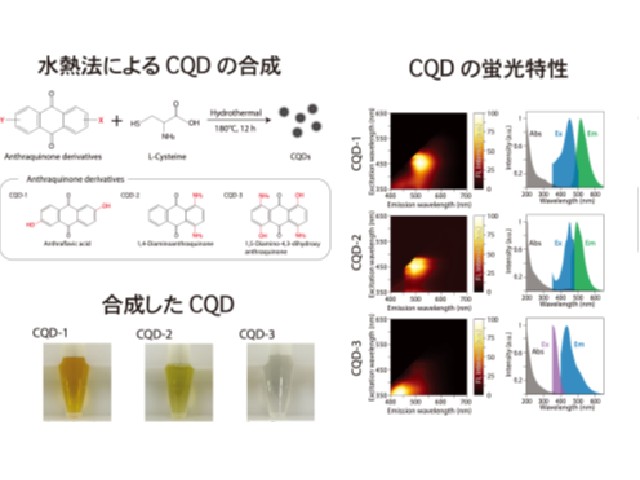
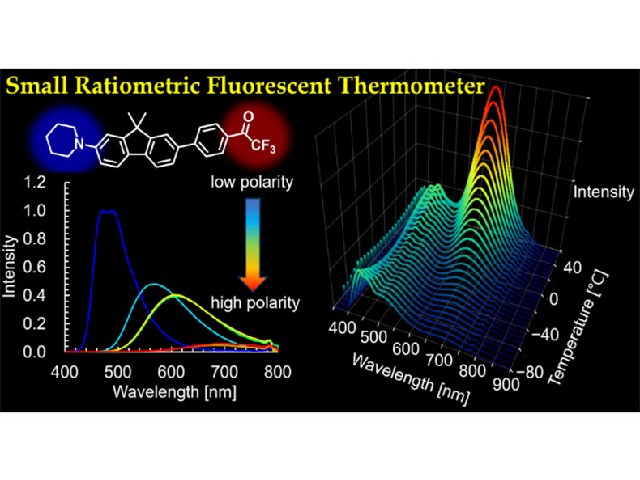
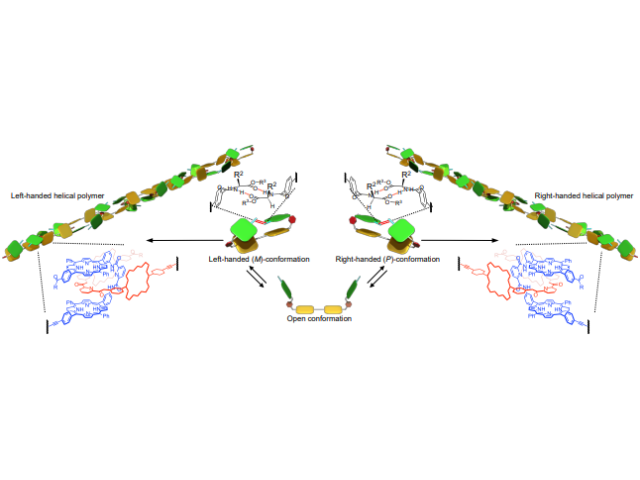
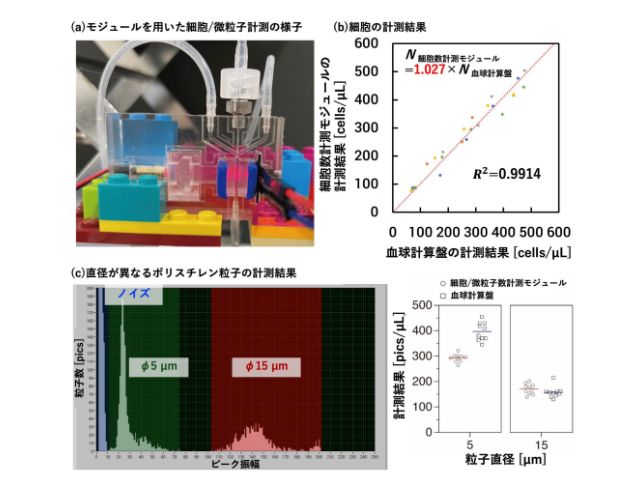
 東京大学の研究グループは,親水性のポリマーに二本の脂質が結合し,光照射によってその内の一本の脂質が切断される分子を開発した(ニュースリリース)。
東京大学の研究グループは,親水性のポリマーに二本の脂質が結合し,光照射によってその内の一本の脂質が切断される分子を開発した(ニュースリリース)。
複数種類の細胞を基材表面の望みの位置に正確に配置する技術として,これまでに光に応答して細胞の付着性が変わる表面が開発されてきた。
しかし,従来の表面は,光に応答して細胞膜上の接着因子と結合する表面ばかりで,接着因子を細胞表面に持っている接着性の細胞にしか応用できない。また,細胞接着を利用する従来法では,一種類の細胞を付着させるのに数時間以上かかり,複数種類の細胞を配置するには長時間が必要だった。
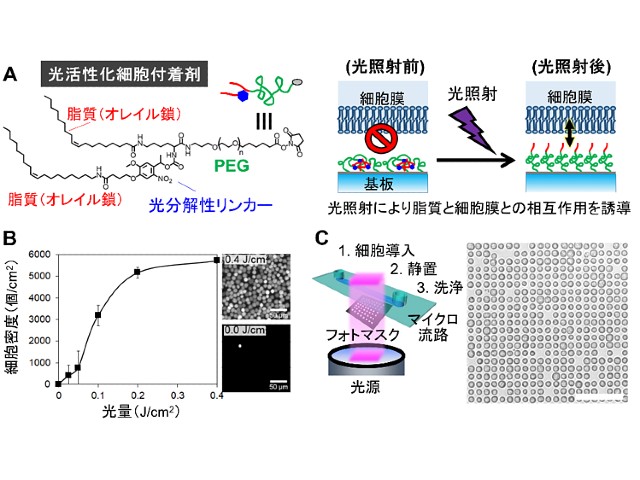
今回研究グループは,細胞の接着性を利用しない光応答性の細胞付着表面を開発した。まず,親水性のポリマーであるポリエチレングリコール(PEG)の片方の末端に脂質であるオレイル鎖が二本結合し,もう片方の末端で基材表面に修飾できる分子を合成した。
この分子の一本のオレイル鎖は,波長が350~405nmの光を照射すると切断されるように設計した。この分子を高密度に修飾した表面では,二本の脂質部分が水中で自己集合し,細胞の付着を妨げるPEG部分が表面に出る。
一方,光照射によって脂質を一本切断すると,残った方の脂質が表面に露出し,細胞表面の細胞膜と強く相互作用することを明らかにした。この表面は,接着因子ではなく,細胞の表面には必ず存在する細胞膜と結合するため,昆虫細胞からヒトの免疫細胞に至るまで,細胞の接着性に関わらずどんな細胞も瞬時に付着できた。また,光照射と細胞の付着を繰り返すことで,短時間で複数種類の細胞を配置することに成功した。
これらの特徴を利用して,ヒトの血液検体に含まれるナチュラルキラー細胞(NK細胞)を1細胞ずつ等間隔に並べ,その横に隣接するように白血病細胞を配置し,両者の相互作用を経時観察した。
その結果,NK細胞が白血病細胞を殺す様子を最初から最後までリアルタイムで顕微鏡観察でき,その細胞ペア一つずつの観察画像データの機械学習によって,白血病細胞を殺傷するNK細胞と殺傷しないNK細胞を自動分類できた。さらに,異なるメカニズムで細胞死を誘導するNK細胞の集団を識別することにも成功した。
この技術は,がん細胞傷害性の高い免疫細胞を識別することができるため,治療用のTCR-T細胞の選別や,CAR-T細胞の品質管理に貢献することが期待されるという。また,特徴的な細胞間相互作用を示す細胞を1細胞レベルで識別できるため,その細胞表層のタンパク質を調べることで,新しい治療や診断用の標的分子の発見にもつながると研究グループは期待している。