では,なぜバナジウムアパタイトが可視光応答性を発現したのだろうか。バナジウムアパタイトの可視光応答性の光触媒反応機構を調べるため,酸素の還元能を調べた。光触媒反応は,光を吸収することで価電子帯の電子が伝導帯に励起することで引き起こる。価電子帯に生成した正孔が酸化反応に寄与し,有機物を酸化分解していくのに対して,伝導帯に励起した電子は還元反応に寄与する。
光触媒反応は,正孔による酸化反応と電子による還元反応の両方が起こらなければならない。光触媒を空気中に使用する場合,還元される物質は酸素であるため,酸素の還元能を調べることは重要である。酸素は,主に一電子還元されてO2–,もしくは二電子還元されてH2O2になる。
どちらかになるかは,主に励起電子の酸化還元電位によって決まる。酸素がO2–に還元される酸化還元電位とH2O2に還元される酸化還元電位は異なるため,これらの量的関係を調べることで,励起電子のエネルギー準位の関する有用な情報が得られる。具体的には,酸素がO2–に還元される酸化還元電位のほうが,H2O2に還元される酸化還元電位よりも高い(ネガティブ)ため,O2–の優勢的な生成が見られる場合は,還元に関与した励起電子が存在するエネルギー準位は比較的高いことを示す。
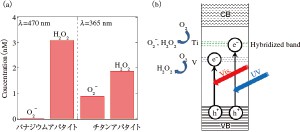
バナジウムアパタイトに可視光を一定時間照射することで生じたO2–とH2O2の濃度を図5(a)に示す。比較のために,チタンアパタイトの結果も併せて示す。チタンアパタイトは紫外光にのみ応答するので,照射光の波長は紫外光とした。チタンアパタイトでは,H2O2よりもO2–のほうが優勢に生成していることがわかった。チタンアパタイトの紫外光応答性は,アパタイトのバンドギャップ内にチタンと酸素の混成バンドによるエネルギー準位が形成されるためと考えられている1)。
O2–の優勢的生成は,この混成バンドのエネルギー準位が,バンドギャップ内で比較的高いところに形成されていることを示している。一方,バナジウムアパタイトでは,O2–よりもH2O2のほうが優勢して生成していた。この結果は,バナジウムによるエネルギー準位が,チタンと比べて,バンドギャップ内の比較的低いところに形成していることを示唆している(図5(b))。
光が照射されると,価電子帯からこのエネルギー準位に電子が励起され,光触媒反応が起こる。これら2つのエネルギー差が小さい程,吸収可能な光のエネルギーは小さくなる。従って,バナジウムによるエネルギー準位は,チタンと比べて低いために,価電子帯とのエネルギー差が縮まり,可視光応答性が発現したと思われる。