 生理学研究所,北海道大学,東北大学は,全パルス光源・タイムゲート検出系を駆使した独自の超解像二光子顕微鏡の開発に成功した(ニュースリリース)。
生理学研究所,北海道大学,東北大学は,全パルス光源・タイムゲート検出系を駆使した独自の超解像二光子顕微鏡の開発に成功した(ニュースリリース)。
二光子励起顕微鏡法は,三次元的な広がりを持つ神経回路網や,その回路網を伝搬する神経活動などを生体脳内で観察することを可能としてきたが,対物レンズの開⼝数と⼆光⼦励起波⻑によって規定される励起光の回折広がりにより,300nm程度でしかイメージングできず,シナプス後部(樹状突起スパイン)の微細な形態変化を可視化するのは難しい。
これを打破するため,二光子励起STED顕微鏡法を用いることで生体脳内のスパイン形態の時空間ダイナミクスをナノスケールで可視化したという報告がいくつかあったが,高度で複雑な光源系・光学系を構築する必要があり,広く一般化された技術とは言い難い状況だった。
研究グループは,超解像技術の黎明期より独自の光技術を統合し,コンパクトかつ低侵襲的な超解像二光子励起STED顕微鏡の開発を進めてきた。
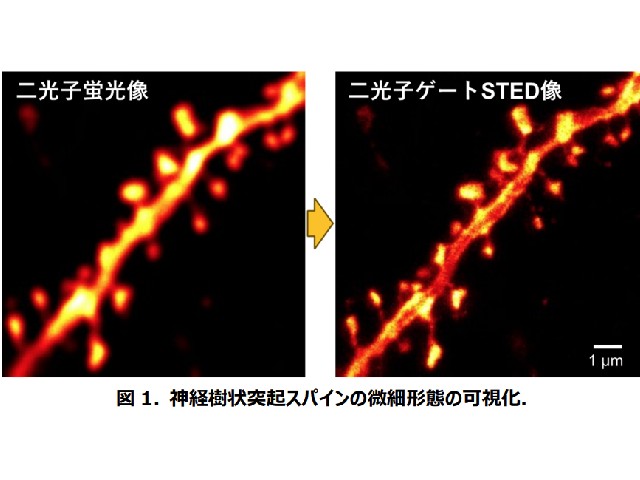
その空間分解能は従来の二光子励起顕微鏡の約5倍,70nmに達したが,脳組織スライスなど比較的厚みのあるサンプルでは,STED光照射に起因するバックグラウンドシグナルの上昇により空間分解能が顕著に劣化するといった問題があった。
この研究では,蛍光光子をサブナノ秒の精度でタイムゲート検出するためのシステムを新たに導入し,二光子励起はもちろんSTEDにもパルスレーザー光源を採用した二光子励起ゲートSTED顕微鏡を世界に先駆けて開発することに成功した。
全パルス光源系を用いることで観察対象への光照射を極限まで削ぎ落としSTED顕微鏡法でしばしば問題となる光ダメージの影響を抑えること,蛍光光子のタイムゲート検出により空間分解能の劣化に繋がる生体分子由来のバックグラウンドシグナルを除去すること,の両方を同時に実現することができた。
特に脳組織イメージングにおけるタイムゲート検出の効果はこれまで考えられてきた以上に大きく,ゲート検出範囲の最適化により従来の二光子STED像に比べてさらに約1.4倍も高い空間分解能でマウス固定脳スライスにおけるスパインの微細形態を可視化できることを見出した。
研究グループは,実際の生体深部観察へと展開するには,組織による光学収差を補償する技術や,明るい蛍光プローブの選定・開発,多色化なども重要だとしている。今後は,生きたまま,ありのままで,体の中を電子顕微鏡のように観察できる「生体ナノイメージング」を目指して,1つ1つの課題をクリアしていきたいとしている。