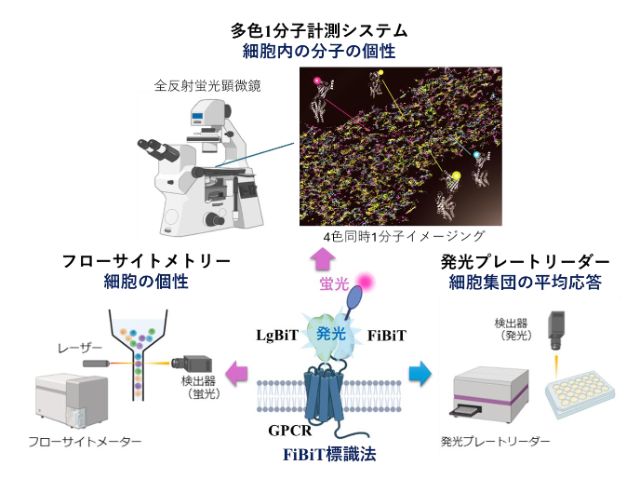
 理化学研究所(理研)と広島大学は,マウスES細胞で働く転写因子の挙動を1分子精度で定量解析し,ES細胞の分化多能性を維持するための新しいメカニズムを発見した(ニュースリリース)。
理化学研究所(理研)と広島大学は,マウスES細胞で働く転写因子の挙動を1分子精度で定量解析し,ES細胞の分化多能性を維持するための新しいメカニズムを発見した(ニュースリリース)。
ES細胞は,体のどの細胞にも分化できる性質(分化多能性)を持っている。NanogとOct4は,ES細胞が分化多能性を維持するために必須の転写因子であり,自分自身の発現をそれぞれ促進させるとともに,互いの発現も促進させるが,NanogやOct4の細胞内での分子動態とクロマチン構造の変化,分化多能性との関連性は明らかにされていなかった。
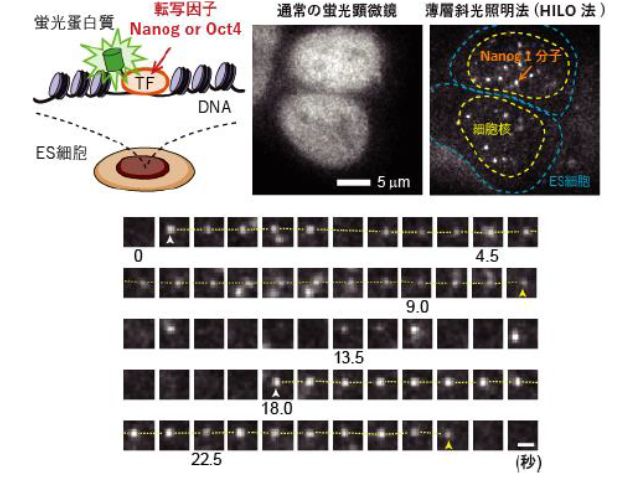
そこで研究グループは,ゲノム編集技術を用いて,NanogもしくはOct4と蛍光タンパク質との融合タンパク質を発現するマウスES細胞を作製した。
通常の蛍光顕微鏡は,背景光が強過ぎて微弱な蛍光分子一つの信号を検出できない。薄層斜光照明法(HILO法)は,対物レンズの端にレーザー光を入射させ,円筒状のレーザー光をつぶして板状に成型しつつ,細胞をシート状の光で「切る」ように照射する。
これにより焦点面以外への励起を防ぎ,背景光を劇的に減少させ,転写因子に融合した蛍光タンパク質を,生きたES細胞の核内で1分子ずつ観察できる。
研究グループは,分化多能性の程度に応じた三つの培養条件(基底状態,未分化状態,分化誘導後)において,NanogおよびOct4を蛍光タンパク質によりそれぞれ標識した2種類の細胞について1分子観察を行なった。
遊離状態の転写因子は細胞核内をカメラでは撮像できないほど速く拡散運動しているが,転写因子が標的遺伝子座と相互作用すると運動が停止するため,輝点として捉えることができる。
輝点の運動を網羅的に計測する1分子追跡法(SMT)と,新たに開発した全自動輝点識別アルゴリズムを用いた解析の結果,Nanogは分化が始まるとDNA上に長くとどまるようになるなどの新たな相関を発見し,NanogとOct4が協働してES細胞の分化が進み過ぎないように制御するという新しい「負のフィードバック機構」の提案した。
ES細胞やiPS細胞を安定に供給するために,ES細胞やiPS細胞の分化多能性を維持したまま培養することは必須。研究グループは,この成果により新しいES/iPS細胞の安定樹立法,安定培養法が開発されることが期待できるとする。
また,今回の研究で用いた1分子輝点の自動認識アルゴリズムにより,転写因子の1分子計測が容易となるため,さまざまな転写因子の細胞核内における挙動が明らかになるとしている。