 順天堂大学と大阪大学は,全脳スケールからシナプススケールまで神経回路の構造をズームインしながら観察する手法の開発に成功した(ニュースリリース)。
順天堂大学と大阪大学は,全脳スケールからシナプススケールまで神経回路の構造をズームインしながら観察する手法の開発に成功した(ニュースリリース)。
近年,開発の進む組織透明化技術により,光学顕微鏡で脳を大規模に観察することが可能となったが,シナプス観察には電子顕微鏡が必要となる。
そこで研究グループは,組織透明化技術によって大規模構造データを取得した標本において,標的構造にズームインして電子顕微鏡解析を行なうことのできる技術を開発し,広い視野と高い解像度の両立を目指した。
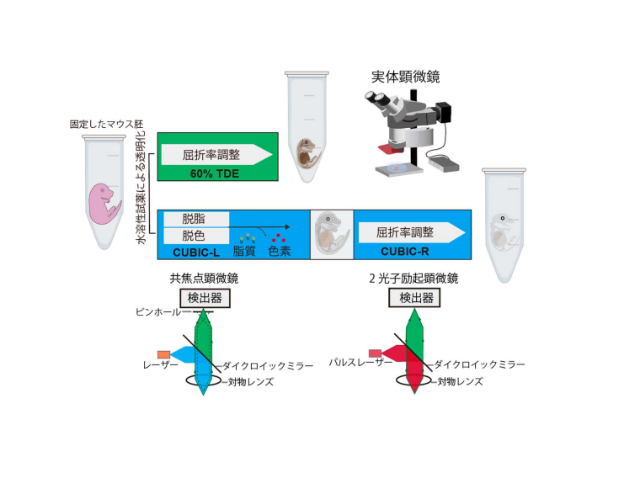
まず,超微細構造へのダメージを最小にする透明化法を開発し,これにより標本は組織の膨張や収縮を引き起こすことなく,従来法と同等の透明度を示した。また,グルタールアルデヒド(GA)により固定した脳組織も,組織の膨張や収縮をほとんど伴わずに透明にすることができた。さらに,従来法と比較してシナプスなどの超微細構造が格段に保持されていた。
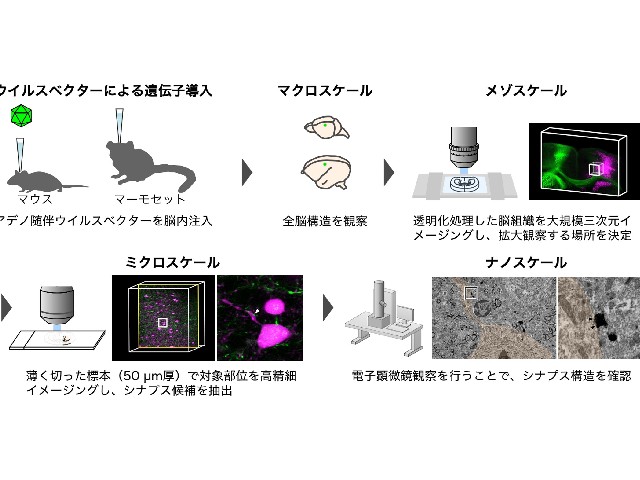
次に光学顕微鏡と電子顕微鏡との両方で目的構造を標識することができる遺伝子発現システムを開発した。アデノ随伴ウイルスベクターを利用して,感染した細胞内で緑色蛍光タンパク(GFP)とアスコルビン酸ペルオキシダーゼ(APEX2)の融合タンパクを高発現するシステムの構築に成功した。
このシステムでは,GFPで標識された感染細胞は光学顕微鏡(蛍光顕微鏡)で観察でき(メゾスケール・ミクロスケール),その後にAPEX2の反応によってジアミノベンジジン(DAB)という色素をその細胞に沈着させることにより,標識細胞の超微細構造を電子顕微鏡を用いて観察することが可能(ナノスケール)となる。これらの技術を組み合わせることで,全脳構造からシナプス構造までの神経回路構造をズームインしながらシームレスに観察できる。
研究グループは,このアデノ随伴ウイルスベクターの脳内注入により作製した脳組織標本に対し,開発した透明化法を施すことで,光学顕微鏡による脳構造の大規模構造データを取得した。標識された神経細胞は細胞体だけでなく,その入力部位である樹状突起や,出力部位である長い軸索までもがGFPにより可視化されていたという。
そうした神経突起(樹状突起や軸索)に狙いをつけて,DABを沈着させた後に電子顕微鏡により観察したところ,細胞体から遠く離れた神経突起の超微細構造はきちんと保存され,かつDABにより標識されており,シナプスレベルの構造解析が可能であることが確認された。これらの実験はマウスとマーモセットの両方で実現した。
研究グループはこの成果により,これまで見つけることができなかった病態の発症機序や薬理作用を明らかにすることができるとしている。