 三重大学,茨城大学,沖縄科学技術大学院大学は,微生物発酵などの利用が進んでいる光合成細菌の一種Rhodobacter sphaeroides(ロドバクタ―・スフェロイデス:Rba. sphaeroides)の「膜タンパク質コア光捕集反応中心複合体」をクライオ電子顕微鏡により立体的に可視化することに成功した(ニュースリリース)。
三重大学,茨城大学,沖縄科学技術大学院大学は,微生物発酵などの利用が進んでいる光合成細菌の一種Rhodobacter sphaeroides(ロドバクタ―・スフェロイデス:Rba. sphaeroides)の「膜タンパク質コア光捕集反応中心複合体」をクライオ電子顕微鏡により立体的に可視化することに成功した(ニュースリリース)。
光合成を行なう際,植物やシアノバクテリアでは酸素を発生するが,光合成細菌は酸素を発生せず,非常に高い効率で太陽の光を電子エネルギーへ変換できるように進化してきた。
光合成細菌の棲息環境は広く,環境に応じて光捕集メカニズムが最適な装置になるようそれぞれが進化のバイアスを受けている。酸素非発生型として効率を重視した独自の進化過程を遂げる一方,独自に発展した立体構造と機能との相関性は不明な部分も多い。
発酵培養などで広く利用されている光合成細菌ロドバクター・スフェロイデスの光捕集反応中心複合体も謎とされてきたが,光合成細菌は非常に高いエネルギー変換効率を持つことが知られており,酸素を発生しない光合成のメカニズムの解明に期待が寄せられている。
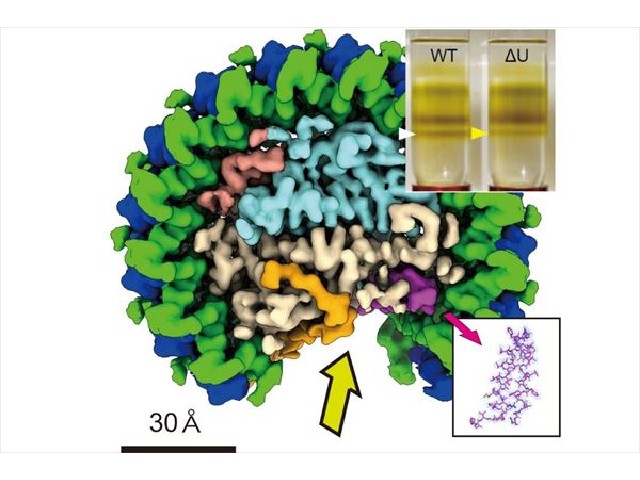
ロドバクター・スフェロイデスのコア光捕集反応中心複合体は,他の種とは異なり,二量体形成(同じ単量体ユニットが二つ集まった分子)もできることが知られており,そのカギとなるPufXの寄与メカニズムを明らかにするために様々な研究が行なわれてきた。今回,複合体内のメカニズムについてクライオ電子顕微鏡を用いて明らかにした。
さらに,実際には確認されておらず,ゲノム情報上のみの仮想存在となっていた膜タンパク質が複合体に含まれていることを発見し,研究グループは「protein-U」と命名した。研究により,protein-U がLH1-RCの二量体形成を安定化させるよう機能していることが示された。
また,カロテノイドついても,可視化により新しい結合位置の存在を認め,新規様式で相互作用していることを明らかにした。今回の詳細な三次元構造は,PufXとともに,protein-U がキノンの出入口を形成していることを示しており,新たなキノンの流入出経路のモデルと,高効率化の可能性を提示するものだという。
今回の研究で可視化した,酸素を発生しない光合成細菌メカニズムについて研究グループは,生物工学でも利用されているロドバクター・スフェロイデスの効率向上の研究を進めるだけでなく,太陽光エネルギーの人工的利用のさらなる発展に貢献することが期待できるものだとしている。