 北海道大学と東京工業大学は,代表的な生体適合性高分子であるポリエチレングリコール(PEG)を環状化し金ナノ粒子と混合することで表面に強く吸着し,高温・低温・生理条件を含む多様な条件において優れた分散安定性を示す方法を開発した(ニュースリリース)。
北海道大学と東京工業大学は,代表的な生体適合性高分子であるポリエチレングリコール(PEG)を環状化し金ナノ粒子と混合することで表面に強く吸着し,高温・低温・生理条件を含む多様な条件において優れた分散安定性を示す方法を開発した(ニュースリリース)。
現在,金属ナノ粒子を含む数多くのナノ粒子系医薬品が盛んに研究されているが,造影剤や薬物を内包するドラッグデリバリーシステム(DDS)用のキャリアも含め,それらの多くは粒子表面が生体適合性のポリエチレングリコール(PEG)で覆われたものになる。
このPEGによる修飾はPEGylationと呼ばれ,生理的条件下での分散安定性を得られるともに,生体内での免疫系による検出から保護される。しかし,ナノ粒子系医薬品のPEGylationはチオールに代表される化学吸着に基づくため,対応するPEG化剤の合成が必要な上,手順が煩雑であり,十分な分散安定性が得られないこともあるという。そのため,ナノ粒子の簡便かつ安定したPEGylation は,生物学的応用に限らず幅広い領域で求められている。
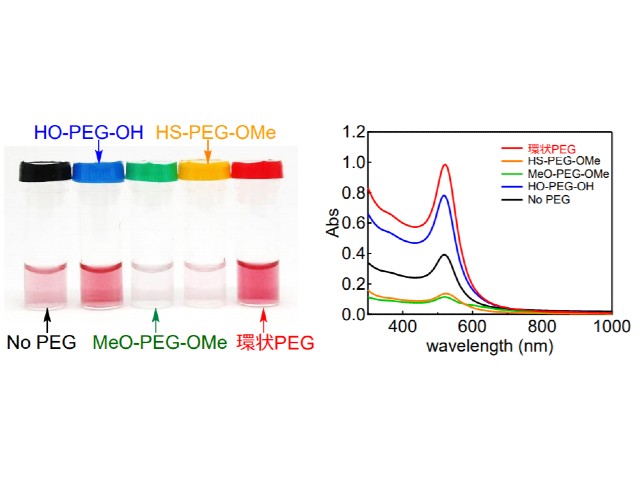
研究グループは,直径約十数nmの金ナノ粒子の水分散液に対し,両末端に水酸基(HO–)を持つ直鎖状HO–PEG–OH,両末端にメトキシ基(MeO–)を持つ直鎖状MeO–PEG–OMe,チオール(HS–)と金属原子の化学反応によりナノ粒子のPEG化剤として広く利用される直鎖状HS–PEG–OMe及び直径数nmの環状PEGをそれぞれ加え,冷凍,加熱,生理条件下での分散安定性を調査した。また,凍結乾燥後に再分散についても評価した。さらに,マウスを用いた動物実験を行ない,生体適合性,血中滞留性及び腫瘍への蓄積性を評価した。
その結果,HO–PEG–OHやMeO–PEG–OMeでは無修飾の金ナノ粒子とほとんど変わらず不可逆的に沈殿したのに対し,環状PEGを加えた金ナノ粒子は,これらの過酷な条件下でも分散安定性を保持した。さらに,HS–PEG–OMeを用いた場合でも,上述の加熱条件には耐えられずほとんど再分散できなかった。つまり,環状PEGは従来のHS–PEG–OMeよりも優れた分散安定剤であることが示された。さらに,動物実験では環状PEG修飾金ナノ粒子の生体適合性,血中滞留性及び腫瘍への蓄積性も確認された。
今回開発した技術は,バイオの応用分野において革新をもたらす製品開発へとつながるという。例えば,環状PEGによって修飾された金ナノ粒子,銀ナノ粒子,超微細酸化鉄ナノ粒子は,バイオイメージング素子の他に腫瘍の光温熱治療の新たなツールとして期待できるとしている。