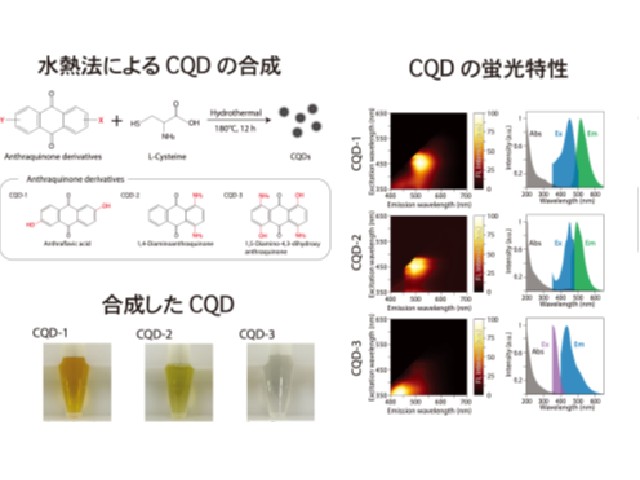
 豊橋技術科学大学の研究グループは,原子間力顕微鏡(Atomic Force Microscopy:AFM)を高機能化することで,生きたままの細胞をナノ空間に制御した光触媒酸化反応を利用して低侵襲に加工し,細胞内部の生体分子の動的な情報を可視化することに成功した(ニュースリリース)。
豊橋技術科学大学の研究グループは,原子間力顕微鏡(Atomic Force Microscopy:AFM)を高機能化することで,生きたままの細胞をナノ空間に制御した光触媒酸化反応を利用して低侵襲に加工し,細胞内部の生体分子の動的な情報を可視化することに成功した(ニュースリリース)。
医療・医薬分野のさらなる発展には,生命現象の統合的理解とその制御が必要不可欠となる。このためには,ゲノム,タンパク質,糖鎖などの生体分子の構造・機能解明に加えて,生命活動の基本単位である細胞の機能を解き明かすことが,ライフ・イノベーション創出の命題となる。
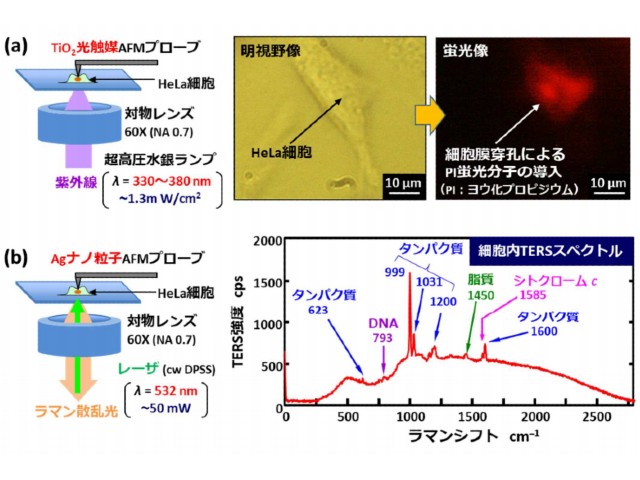
今回,研究グループは,原子間力顕微鏡(AFM)に新たに2つの機能を搭載することに成功した。一つ目は,光触媒として知られる酸化チタン(TiO2)薄膜をAFMプローブの探針先端に被覆した。
この方法によって,光触媒反応を探針の極先端近傍のナノ空間(100nm領域)に局在化することで,低侵襲な細胞膜穿孔を実現し,その結果,細胞膜の穿孔確率は100%となり,細胞の生存確率も100%と低侵襲に加工が行なえることを実証することができた。
二つ目は,銀(Ag)ナノ粒子を被覆したAFMプローブの探針先端を生きた細胞内に挿入することで,タンパク質,DNA,脂質などに起因する高感度なラマンスペクトル(チップ増強ラマン分光法:Tip-Enhanced Raman Spectroscopy:TERS)の取得に成功した。
この方法によって,細胞内部の情報として,細胞核と細胞質での生体分子の構成比率の違いの可視化や,細胞内部の生体分子の時系列変化として,タンパク質とグリコーゲン(動物デンプンとも呼ばれる)の増減に逆相関(一方が増加すると一方が減少する現象)があることを見出した。
研究グループは今後,ナノ加工・計測機能を同時に実現するために,TiO2光触媒AFMプローブの表面にAgナノ粒子を被覆させることで,光触媒酸化反応に基づく有機物の分解反応過程(分子の構造変化)を加工プロセス中で可視化できるラマン分光(TERS)機能を確立するとしている。
さらに,抗原抗体反応の高い分子認識機能を利用することで,標的となる細胞の膜タンパク質の一分子計測手法の実現と,それによって特定した標的膜タンパク質の選択的な一分子ナノ加工技術の確立に向けてさらなる進化を目指す。この技術は,生命機能メカニズムの解明ならびに新規医薬品の開発などへの応用展開が期待できるものだとしている。