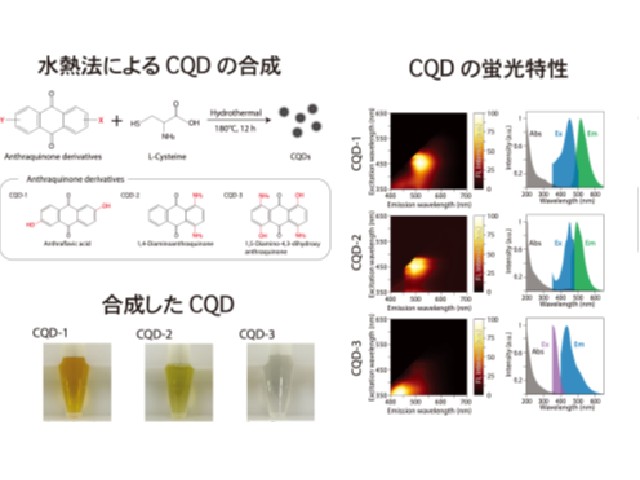
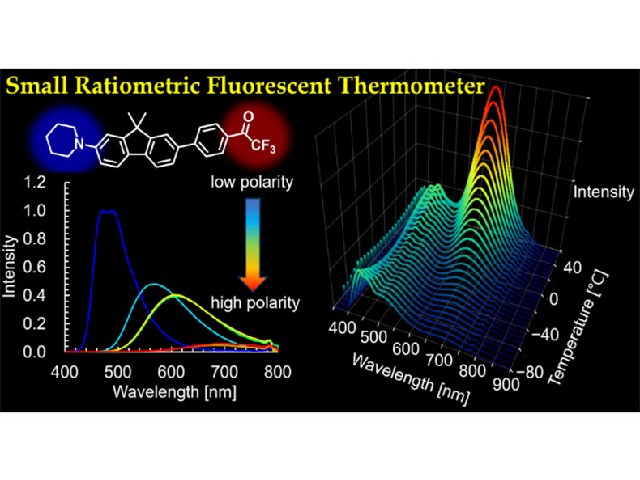
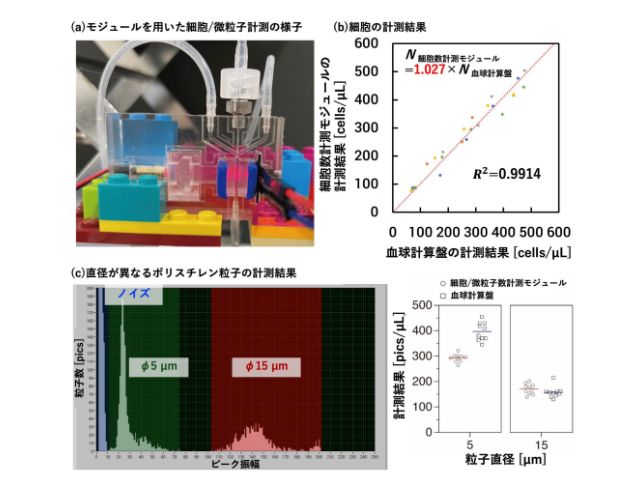
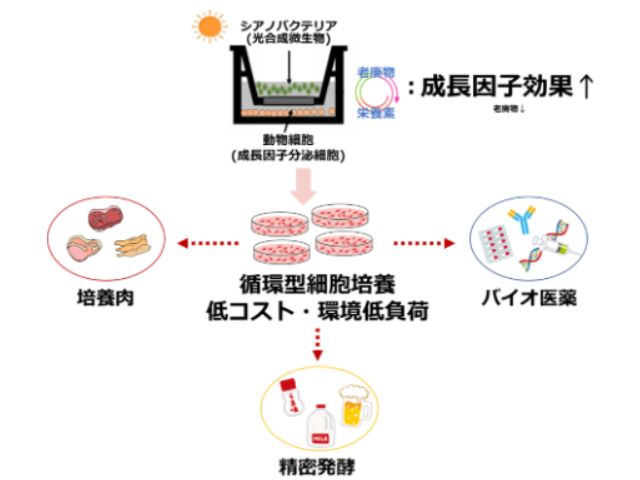
 東京大学の研究グループは,細胞を活き活きとした状態で培養できる100pLから1nL程度の大きさの微小液滴カプセルを,超高速に操作する手法「逐次駆動誘電泳動力配列アレー(Sequentially addressable dielectrophoretic array;SADA)」の開発に成功した(ニュースリリース)。
東京大学の研究グループは,細胞を活き活きとした状態で培養できる100pLから1nL程度の大きさの微小液滴カプセルを,超高速に操作する手法「逐次駆動誘電泳動力配列アレー(Sequentially addressable dielectrophoretic array;SADA)」の開発に成功した(ニュースリリース)。
単一の細胞を液滴内で培養することにより,例えば,細胞からの分泌物を1細胞レベルで計測することが可能になる。さらに,液滴はマイクロ流路中に流して超高速に操作することが可能なので,これらの解析を短時間で大規模に行ない,かつ有用な細胞を分取することが可能になる。
しかし従来の技術では,液滴の大きさと,1秒間に分取可能な液滴数がトレードオフの関係となっており,液滴マイクロ流体工学技術の応用範囲は制限されていた。
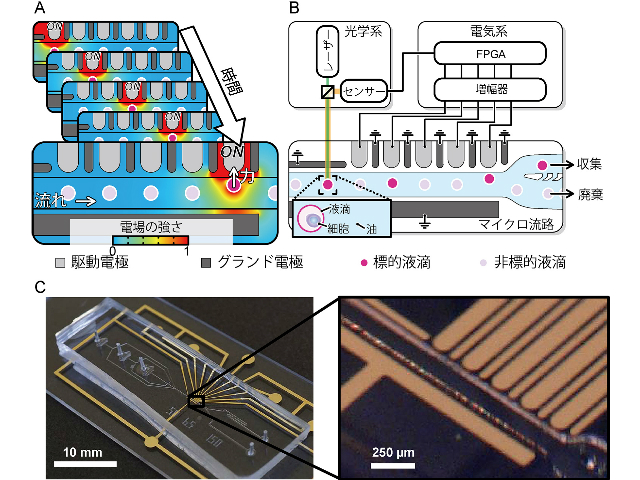
この技術では,液滴に加える力のタイミングと位置を巧みに制御することにより,壊れやすい大きな液滴を,優しくかつ超高速に操作することが可能となる。
具体的には,電極配列のそれぞれの電極を,標的液滴の流れてくるスピードに合わせて順次駆動することにより,電極への引力を標的液滴に追随するように加えることができるので,瞬間的な大きい力を加えることなく超高速操作することが可能になる。
さらに,発生する力が局所的な力となるように電極が設計されているので,標的液滴のすぐ隣を流れる非標的液滴には力が加わらずに,標的液滴のみを分取することが可能となる。従来の技術では,高速操作のために瞬間的な大きい力を加える必要があり,大きな液滴を壊さずに操作することは困難だったが,この技術を用いることにより,その難しさを克服し,20倍の高速分取を実現した。
さらに,iPS細胞,がん細胞,藻類細胞などの大きな細胞や,凝集性を示す細胞を液滴に封入して分取することが可能であることも実証した。
また,この技術が得意とする100pL以上の大きさの液滴内において,藻類細胞が自由に運動できること,その藻類細胞や白血病細胞の生存率が上がること,ハイブリドーマ細胞の抗体産生量が上がることを示した。さらにこの技術を用いて,母集団の約2%程度しか存在しない増殖スピードの遅い微生物を単離する原理実証を行ない,この技術の有用性や汎用性を確認した。
この技術により,液滴に封入されている細胞に関する情報の解析と分取を大規模に行なうことが可能となり,精密医療,ウイルス検査,創薬,スマートセル産業などへの展開が期待されるとしている。