 理化学研究所(理研),大阪大学の研究グループは,組織透明化技術「CUBIC」に適した高速イメージング技術「MOVIE」と高速データ解析技術により,透明化した臓器内の全ての細胞を解析する「全細胞解析」を実用化した(ニュースリリース)。
理化学研究所(理研),大阪大学の研究グループは,組織透明化技術「CUBIC」に適した高速イメージング技術「MOVIE」と高速データ解析技術により,透明化した臓器内の全ての細胞を解析する「全細胞解析」を実用化した(ニュースリリース)。
今回研究グループは,透明サンプルの3次元撮影を高速化するために,「MOVIE-scan(高速撮影)」「MOVIE-skip(効率撮影)」「MOVIE-focus(リアルタイムオートフォーカス)」からなる高速イメージング技術「MOVIE」を開発した。
一般的な方法では,撮影よりもサンプルの移動・停止に時間がかかることから,MOVIE-scanでは,サンプルを等速移動させながら撮影を行なうことで,時間を短縮した。
また,顕微鏡の視野よりも大きいサンプルは,複数のタイル領域に分割して撮影される。この撮影法では,撮影対象であるサンプルの外側の画像も取得してしまうことから,MOVIE-skipでは,次のタイルの初期位置にサンプルが戻る際に,サンプルの有無と存在場所を確認することで,サンプル外の空間を撮影する不用な時間を除いた。
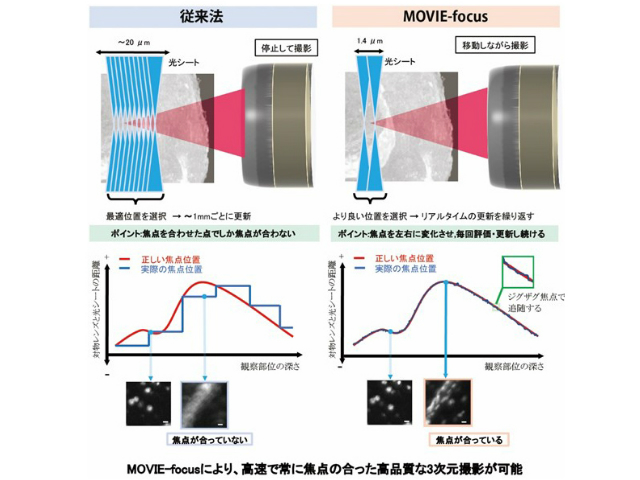
透明化された臓器には,内部構造の違いにより微妙な屈折率の違いがある。そのため,高倍率の対物レンズで観察する場合,焦点がずれた画像にならないよう,対物レンズの焦点位置とレーザー光による光シートの焦点面を一致させる必要がある。
従来法では,一定の間隔(高さ方向,0.5~1mm)ごとに,10~20枚の焦点の異なる画像を静止撮影して画像解析を行ない,最も良い画像だった位置に焦点を調節し直すことで補正していた。このため,焦点を補正し直す直前は焦点のずれた画像になりやすく,高い品質で3次元撮影することが困難だった。
MOVIE-focusでは,光シート焦点面を毎回前後に微妙に振動させ,サンプルの移動に伴って生じた焦点位置が前後どちら側に変化したのかをリアルタイムで画像解析し,光シート位置の補正を行なう。つまり,移動しながら常に焦点を合わせ続けるため,毎回明瞭な画像を得ることができ,従来法に比べて高速で常に高品質な3次元撮影が可能になった。
次に,この「MOVIE」を用いて,高速・高解像の「光シート蛍光顕微鏡(MOVIE顕微鏡)」を作製した。観察用対物レンズの直後にダイクロイックミラーを置いたことで,異なる波長の蛍光シグナルを分離し,2台のカメラで同時に撮影できるため,細胞の位置情報(核画像)と細胞の状態情報(蛍光タンパク質,免疫染色画像など)の関係を正確に知ることができる。
これらによって,従来では1秒間に4枚程度しか撮影できなかったのが20枚以上の画像を取得できるようになり,1億個の細胞から構成される透明化されたマウス全脳の場合,従来の5分の1以下にあたる5~12時間で高解像に撮影できるようになったという。