筑波大学は,多能性幹細胞を生きたまま観察するだけで,その品質が定量的に評価できる顕微鏡システムの開発に成功した(ニュースリリース)。
再生医療では,人工多能性幹細胞(iPS細胞)や胚性幹細胞(ES細胞)を分化させて利用する。しかしこれらの細胞の多能性が低いと,分化誘導効率が悪いため,分化しきれない細胞が残存し,腫瘍等を形成するリスクが増大する。
このリスクを軽減するためには,細胞の多能性を評価し,多能性幹細胞の品質を管理する必要がある。多能性の評価には,細胞を固定・破壊して遺伝子やその発現パターンを調べる方法や,長期間をかけて分化誘導を行う方法があるが,これらの多能性幹細胞の品質管理方法には大きな労力とコストがかかる。
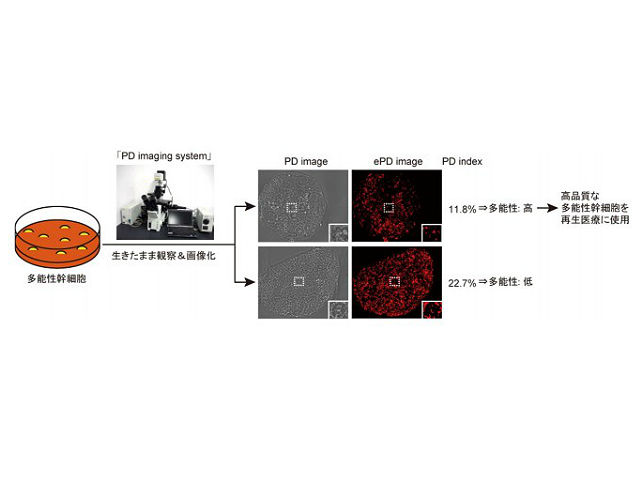
今回,研究グループは,オリンパスが技術開発した「RM-DIC顕微鏡」を改良し,細胞内の微小構造を無染色で画像化できる「PD imaging system」の開発に成功した。このシステムで得られた画像の処理方法を最適化すると,細胞内のミトコンドリア量を定量的に評価できることを見出した。
具体的には,微分干渉顕微鏡の特性として,得られた画像のシアー方向によって画像の鮮明さに違いがあるので,RM-DIC顕微鏡にシアー方向を切り換える機構を追加することによって,直交するシアー方向を持つ2枚の画像を一つの視野で取得することを可能にした。このようにして得られた2枚の画像を重ね合わせる際の画像処理方法を最適化することによって,シアー方向の影響の無い細胞像の取得が可能になった。
ミトコンドリア活性は多能性と逆相関することから,「PD imaging system」で多能性幹細胞を画像化すると,細胞を固定・破壊せずに生きたままで細胞の多能性が定量的に評価できる。実際に,多能性の異なるiPS細胞群を「PD imaging system」で画像化すると,高い多能性を持つ高品質なiPS細胞を選別することができた。
「PD imaging system」で得られた多能性幹細胞コロニーの画像から,その断面像を重ね合わせると,3次元画像を構築することができる。この3次元画像からコロニーの形態や内部構造の情報を抽出し,多能性幹細胞コロニーの多能性を評価することにも成功した。
研究グループは,このシステムは,多能性幹細胞の品質管理に関わる労力やコストを大幅に削減できる可能性を持っており,多能性幹細胞を用いた再生医療の実用化に大きく貢献するテクノロジーになると期待できるとしている。