 大阪大学と独ルール大学は共同で,光合成で働く巨大な膜たんぱく質(光化学系I)が,光のエネルギーを使って電子を伝達する姿の構造解析に成功した(ニュースリリース)。
大阪大学と独ルール大学は共同で,光合成で働く巨大な膜たんぱく質(光化学系I)が,光のエネルギーを使って電子を伝達する姿の構造解析に成功した(ニュースリリース)。
光合成反応は,地球上の全ての生命体を支える重要な反応で,生成する酸素や取り込む二酸化炭素の量が地球環境を決定づけているといっても過言ではない。光合成反応は光エネルギーを化学エネルギーに変える電子伝達部と,その化学エネルギーを利用して二酸化炭素を取り込む部分とに分かれている。
光合成電子伝達と呼ばれる電子伝達部は主に3種の巨大たんぱく質複合体(光化学系ⅠおよびⅡ,チトクロムb6f複合体)により構成されているが,今回注目した“働いている構造”が分かる光化学系I複合体は,その中で最も大きな分子サイズを持つ。
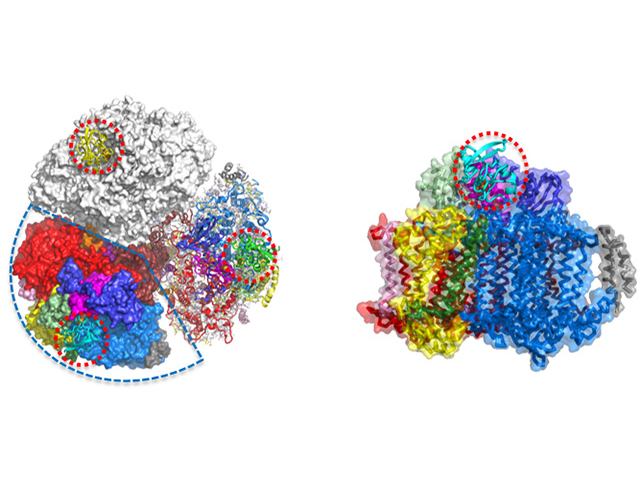
光化学系I単体の構造はすでに報告されていたが,電子伝達する相手であるフェレドキシンと呼ばれる電子キャリアたんぱく質は,非常に弱い相互作用で複合体を形成するため,複合状態での結晶化が難しく,電子をバトンパスする詳細な姿と,その電子伝達の分子メカニズムは不明だった。
研究グループは,フェレドキシンが持つ鉄硫黄クラスターと呼ばれる金属部分を人工的に別の金属に置き換えて,酸化還元状態を均質にすることで,安定な結晶を得る事に成功した。この複合体の結晶を用いて大型放射光施設SPring-8において回折実験を行ない,複合体たんぱく質の構造を原子分解能で解析した。
その結果,フェレドキシンが光化学系Iに結合し,結合した時だけ光化学系Iの三量体が非対称に構造を変化させることを突き止めた。またフェレドキシンの結合に伴い,光化学系Iが玉突き式に構造を変化させて,もう1つの電子キャリアたんぱく質シトクロムとの結合を調整していることも分かった。
以上のことから,電子キャリアたんぱく質の結合が光化学系Iの構造を変化させて効率良く電子伝達することを世界で初めて明らかにした。
電子伝達は相互作用が弱いにもかかわらず非常に特異的に進行する反応で,特に光合成生物ではさまざまな調節機構を持つ。この研究成果のように,光合成電子伝達の巧妙な活性化機構を理解することで植物や藻類の改変指針を得ることができれば,光合成の人工的な最適化や光合成機能の強化につながる可能性があるとしている。