1. 背景
タンパク質の三次元構造は,生命現象の根幹を支える重要な要素である。X線回折を用いて立体構造解析が報告されて以来,核磁気共鳴分光法やクライオ電子顕微鏡,質量分析など,多様な実験技術が開発され,タンパク質の構造と機能の関係が次々と明らかにされてきた。しかしながら,これらの手法が提供するのは基本的に静的な「構造のスナップショット」であり,温度や電場といった外的要因に応じて刻々と変化するタンパク質の動的構造変化,すなわちダイナミクスを直接観察することは難しかった。生命分子はその機能を発現する際に「揺らぎ」や「部分的な変性」を示すことが知られており,そうした中間状態の理解は生命科学や医療応用にとって不可欠である。それにもかかわらず,中間構造を捉える技術は長らく不足していた。この課題に対して,近年注目を集めているのが,一分子計測技術である。この計測技術のうち,ナノポア計測は,直径数ナノメートルの孔を通過する分子を電流変化として検出することで,その大きさや形状,構造状態をリアルタイムに評価できる1)(図1)。DNAやRNAの塩基配列決定,タンパク質の検出,さらにはタンパク質間相互作用の解析にも,基礎研究レベルで広く利用されてきた。ナノポア計測はラベルフリーであり,蛍光標識や表面固定化など分子に改変を施さずに利用できるため,分子本来のふるまいをそのまま観測できるという大きな利点を持つ。しかし,これまでの研究はDNAやRNAといった核酸の通過解析に集中しており,タンパク質の複雑な折り畳み・展開過程,特に中間状態の解明には研究展開されていなかった。

こうした背景のもと,山崎洋人らの研究グループは,フォトサーマル効果による加熱可能な非対称ナノポアを開発し,シトクロムc(Cyt c)の中間的な構造状態を単一分子レベルで観察することに成功したので,この成果について解説する2)。本研究の最大の特徴は,電場刺激だけではなく,局所的な温度変化を組み合わせることで,「中間的な変性過程」を捉えた点である。
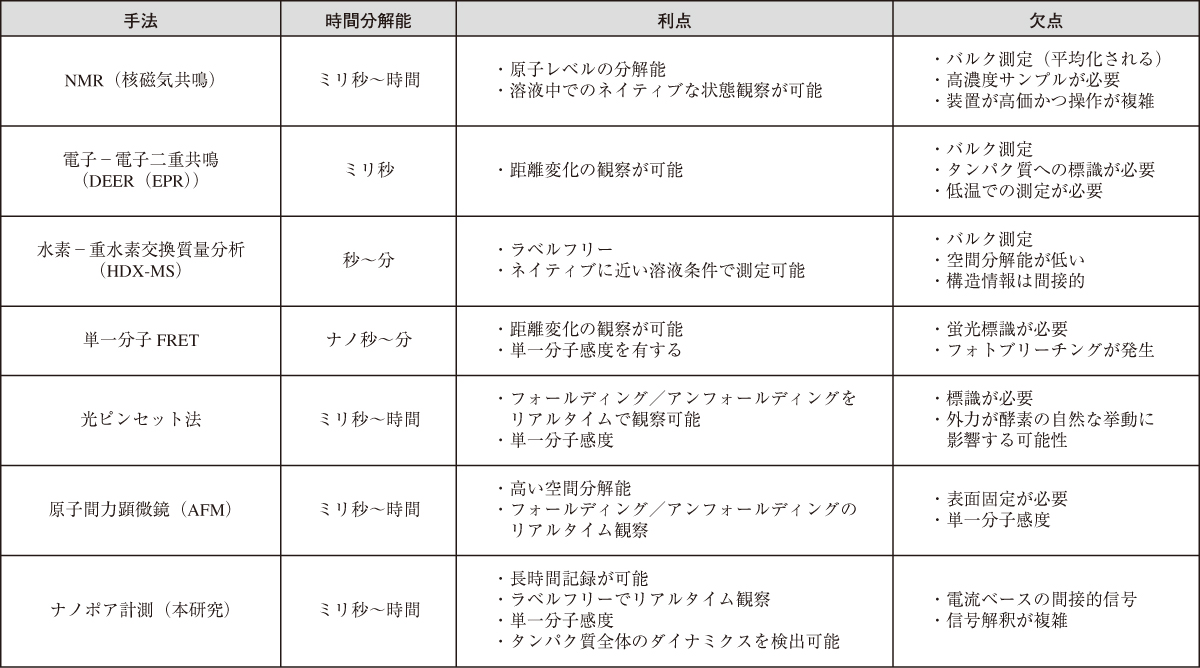
表1では,タンパク質の構造変化やダイナミクスを観察するために用いられる主要な実験手法を比較している。タンパク質は,ピコ秒から時間単位までの幅広い時間スケールで構造変化を示すため,その観察には多様な測定手段が必要である。各手法は時間分解能,空間分解能,試料条件,観察対象,さらには必要なサンプル量や標識の有無などの点で異なる特性をもつ。まず,NMR(核磁気共鳴分光法)は,酵素の原子レベルの構造情報を得られる手法であり,溶液中でのネイティブな構造やダイナミクスを観察できるという利点がある。一方で,測定は大量の試料を必要とし,取得信号は多数の分子の平均的挙動を反映するバルク測定であるため,非同期的な構造変化の観察は難しい。また,装置の操作や解析も高度な専門性を要する。DEER(Double Electron-Electron Resonance,電子−電子二重共鳴)は,電子スピンを用いて分子内または分子間の距離変化をモニターできる手法であり,特に構造変化の距離情報を提供する点で有用である。しかし,低温環境下での測定が必要で,タンパク質へのスピンラベル導入も不可欠であるため,試料調製の難易度が高い。また,これもNMR同様に集団平均的な情報しか得られない。HDX-MS(水素−重水素交換質量分析)は,アミド水素の交換速度を通じてタンパク質の溶媒露出度や構造柔軟性を評価する方法である。この手法はラベルフリーであり,比較的ネイティブな条件下で測定が可能という利点をもつ。しかし,得られる情報は間接的かつ空間分解能が低く,また測定も平均化されたデータであるため,単一分子レベルのダイナミクスは捉えられない。これに対して,単一分子FRET(smFRET)は,2つの蛍光色素間の距離変化をリアルタイムで検出できる代表的な単一分子手法であり,タンパク質が異なる構造状態を行き来する様子を直接可視化できる。しかし,蛍光標識の導入が必要であり,蛍光色素の光退色(フォトブリーチング)による観察時間の制限がある。光ピンセット(Optical tweezers)や原子間力顕微鏡(AFM)も単一分子をリアルタイムで操作・観察できる強力な手法である。光ピンセットでは,分子のフォールディングやアンフォールディングを力学的に追跡でき,AFMでは高い空間分解能で分子の変形や相互作用を観察できる。しかし,いずれも外部から力を加えるため,タンパク質本来の自然な挙動が影響を受ける可能性がある。また,これらの手法でもタンパク質への修飾や表面固定が必要となる。最後に,ナノポア計測は,タンパク質のダイナミクスを単一分子レベルで解析できる新しい電気的手法として注目されている。ナノポア法の最大の利点は,上述のように,ラベルや固定化を必要とせず,タンパク質をそのままの状態でリアルタイム観察できる点である。また,長時間にわたる連続記録が可能で,単一分子の構造揺らぎや反応サイクルを追跡できる。さらに,他の手法と比べて装置構成が比較的簡便であり,少量の試料でも測定ができる。しかし,得られる信号は電流変化という間接的な情報であり,構造状態と電流変化との対応づけが難しい場合もある。このため,データ解釈には,タンパク質構造の理解と物理モデルの両面からの慎重な解析が必要となる。