撮像デバイスは,カメラに分光素子を搭載して,センサーの1次元を位置情報,もう1次元を分光情報の取得に用い,ラインスキャンして3次元データを格納する方式が多く用いられている。筆者らは図2(a)に示されるようなラインスキャン型のデバイスを用い,NIR-HSIの透過特性や成分解析により,組織深部の病変の検出や同定が可能ではないかという仮説のもと,組織深部に病変が存在する症例(消化管間質腫瘍)の摘出検体を用いて解析を行なってきた。そして,正常粘膜(厚み1 mm程度)が覆い被さった検体でも病変領域が識別され,80%を超える精度があることが確認されている6)。そこでさらに,胃がんの切除検体の漿膜側から,がん領域の可視化が可能か検証した。
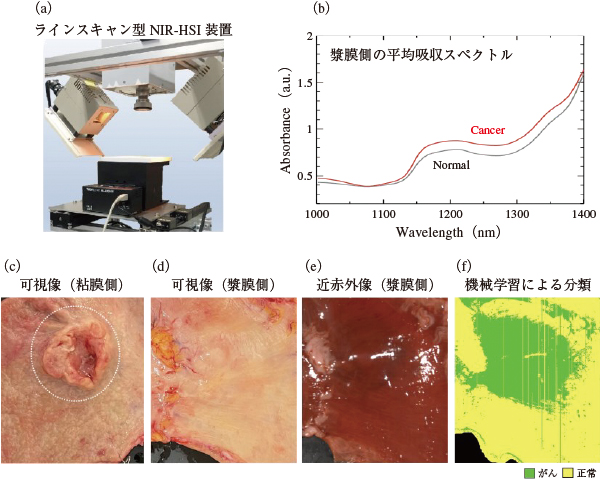
図2(c)に示されるように,胃がんは粘膜側から発生するため,漿膜側から可視像でがんの位置を認識することは難しい。しかし,近赤外波長で撮像すると,漿膜組織が透過して,がんの領域で光の吸収が見られ,コントラストが出ていることが確認できる。また,がんと正常の領域の近赤外スペクトルを抽出すると,図2(b)のように吸収に差が出る波長があることが確認できる。そこで,サポートベクターマシーン(Support Vector Machine:SVM)でがんと正常のスペクトルを学習させて,各画素を分類すると図2(f)のように,がん領域を認識できることが示唆されている。そのため腹腔鏡下でもNIR-HSIを行うことができれば,組織深部の病変や組織間の組成の違いを範囲診断が期待できる。
3. NIR-HSI内視鏡の開発
上記のように,NIR-HSIにより,組織深部のがん等の対象を非接触,非標識で識別できる可能性が示唆されていることから,腹腔鏡下で撮像できるデバイスの開発が期待されている。しかし,可視領域の腹腔鏡用HSIシステムは提案されているが,腹腔鏡用NIR-HSIシステムは報告されていない7)。その要因として,腹腔鏡の光学設計と分光方法がNIR-HSIを取得する際にネックとなっている。
腹腔鏡手術の目として用いられる腹腔鏡は,先端がφ10 mm程度のパイプ状で,レンズの周りにライトガイドの照明系が配置されている構成となっており,像は先端からリレーレンズの光学系を通って,末端部分で平行光になって伝送される。市販されている腹腔鏡は近赤外波長を考慮された設計になっていないため,1000 nm以上の近赤外領域では複数レンズ表面で反射や吸収が起こり,極端に暗くなってしまう。そこで,筆者らのグループでは,このレンズの反射防止コーティングを近赤外用に考慮して特注の腹腔鏡を製造した(図3-①)。
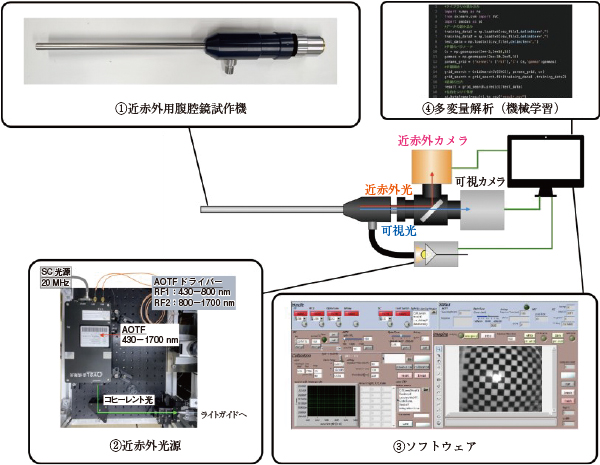
近赤外分光画像を取得する際に,分光装置を搭載したカメラを採用すると,装置が大型してしまう。そこで,ライトガイドに分光光源を接続し,近赤外の波長を掃引して波長ごとの画像を取得する手法を採用した。この分光光源には高出力な白色光を出力できるスーパーコンティニューム(Super Continuum:SC)光源と,電気的に分光波長を抽出することができる音響光学チューナブルフィルタ(Acousto-Optic Tunable Filter:AOTF)を用いることで,430−1700 nmの波長を高速に掃引することができる(図3-②)。この波長掃引の際に,現在市販されている腹腔鏡で近赤外領域の色収差が補正されたレンズが存在しないため,反射防止コーティングを考慮しても波長が変わると焦点が合わない像が取得されてしまう。そこで,電気的に屈折力を制御することのできる液体レンズを用い,波長ごとにフォーカスシフトした焦点を調整する構成とした7)。そして,出力波長選択,焦点合わせ,画像取得のサイクルを回すソフトウェアも開発している(図3-③)。
これらの構成を組み合わせることにより腹腔鏡下でNIR-HSIデータの取得が可能となる8)。NIR-HSIデータが取得されれば,主成分分析やSVM,ニューラルネットワークなどの機械学習アルゴリズムを用いることにより,識別したい対象を分類して可視化することができる(図3-④)。







































