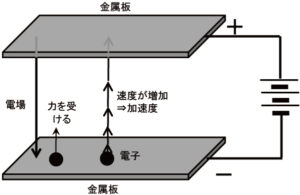
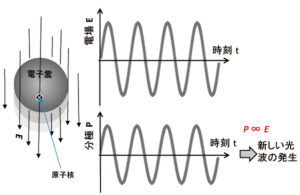
電子の取りうる状態は次の4つの量子数で区別されます。パウリの排他原理によれば,4つの量子数(主量子数n,方位量子数ℓ,磁気量子数mℓ,スピン磁気量子数ms)で決まる1つの量子状態にはただ1つの電子しか入ることができません。
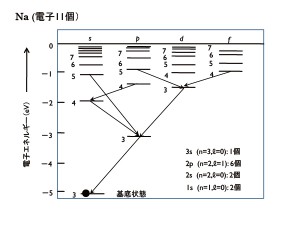
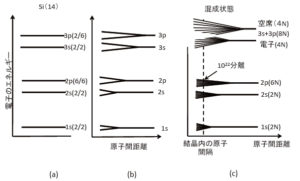
次に,原子番号が11,すなわち11個の電子を持つナトリウム原子(Na)について見てみましょう。最も低いエネルギー状態がn=1,ℓ=0,mℓ=0,ms=±1/2で,2個の電子が入ります。この状態を1sと呼びます。その上にある状態が2s(n=2,ℓ=0,mℓ=0,ms=±1/2)で2個の電子,その上が2p(n=2,ℓ=1,mℓ=–1,0,1,ms=±1/2)で6個の電子が入ることができます。
これで,ナトリウム原子がもっている11個の電子のうち,10個までの状態が決まりました。残る1個の電子がどこに入るのでしょう。直ぐ上に3s(n=3,ℓ=0,mℓ=0,ms=±1/2)状態があり,そこに入っています。電子がこのような状態にあるときが,原子として最も低いエネルギーを取ります。一番上の電子のみに着目して電子の状態を描いたものが図3です。このような状態を基底状態と呼んでいます。
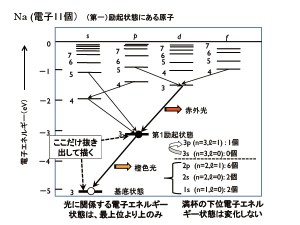
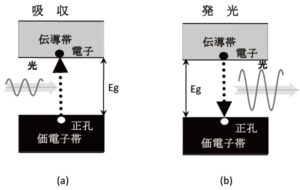
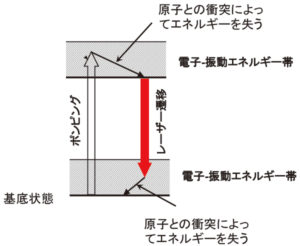
この原子に外部からエネルギーを投入すると,一番上にいる電子がそのエネルギーを吸収して,もっと上の状態に移ります。図4では,3sの直ぐ上の3p状態に移ったものが描いてあります。もっと大きなエネルギーを投入すると,さらに上の3d状態に移る場合もあります。
さらに,もっと大きな5 eV以上のエネルギーを入れると,電子のエネルギーはプラスになり,原子核の束縛から離れて,自由に動き回ることができます。このような電子を自由電子と言います。話を元に戻して,もっとも高いエネルギーを持つ電子が3p状態にあり,その下の3s状態は空席になった状態を第1励起状態と呼んでいます。
図4のような状態になると,原子はできるだけ低いエネルギー状態に戻ろうとします。すなわち,3p状態の電子がエネルギーを失って,下の3s状態に戻ります。このとき,状態間のエネルギー差に相当するエネルギーを光として放出します。これが発光です。