名古屋工業大学の研究グループは,同学が国際共同研究により2018年に発見した,ヘリオロドプシンの光活性化反応を調節する鍵となる水素結合を解明した(ニュースリリース)。
ロドプシンは7回膜貫通αヘリックスからなり,内部にレチナール発色団を結合した光受容タンパク質。視覚や概日リズムを担う動物ロドプシンと,細菌や藻類などの微生物においてイオン輸送,光センサー,光開閉チャネル,光制御酵素などの機能をもつ微生物ロドプシンに大別されていた。
2018年に同学らの研究グループは,新たなロドプシンであるヘリオロドプシンを発見した。微生物ロドプシンと比較してアミノ酸配列の一致度が低く,脂質膜中での配向が逆転しているなどの相違点が挙げられ,生物の新たな光利用戦略を担っている可能性を示す発見となった。
2019年にはX線結晶構造解析により,原子レベルでの立体構造情報を明らかにした。その後,2022年に光で水素イオンを輸送するヘリオロドプシンを発見し,他の研究グループからもグルタミン合成酵素の光制御,光修復酵素の活性化,ABC輸送体の光制御などの多様な機能が報告された。
レチナールの光異性化によって形成される反応中間体の中でもO中間体が重要であり,その形成に伴う構造変化によりタンパク質の活性制御を行なっていると考えられている。ヘリオロドプシンの光反応機構を解明するためにはO中間体の形成・崩壊過程が鍵となると考えられてきた。
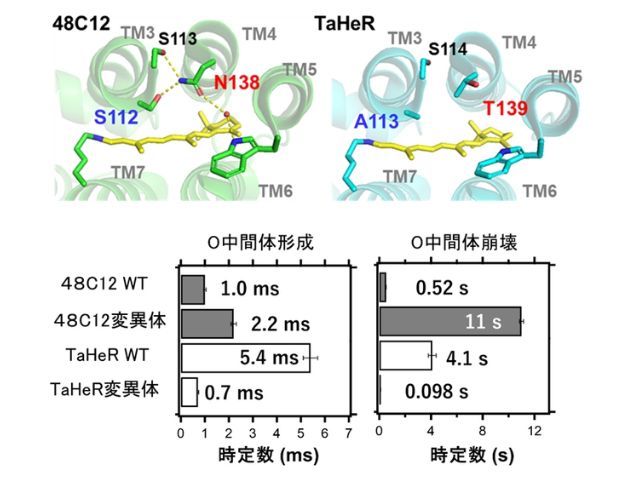
研究グループは今回,ヘリオロドプシン内の3番目のヘリックスに存在するセリン残基と4番目のヘリックスに存在するアスパラギン残基が形成する水素結合が決定的な役割を果たすことを明らかにし,それぞれのアミノ酸残基の一文字表記(セリンはS,アスパラギンはN)から,SNapボンドと命名した。
また,量子カスケードレーザーを用いたデュアルコム分光法により,SNapボンドによりヘリックス構造の歪みが生じ,O中間体の形成や崩壊を速めていることも明らかにした。
研究グループは,SNapボンドの有無によりヘリオロドプシンの活性化状態の調節を可能とし,新規オプトジェネティクスツールの開発につながる研究成果だとしている。