大阪大学と岡山大学は,骨内部の規則化した原子配列構造(骨基質配向性)が,細菌感染への高い抵抗性を示すことを発見した(ニュースリリース)。
脊椎スペーサや人工関節などの骨デバイスの埋入において,術後感染症は重篤な合併症の一つ。従来使用されている抗菌性インプラントは細胞毒性が報告されているほか,既存の抗菌性表面処理では,抗菌効果の持続時間が短いことも課題だった。
研究グループは,骨基質配向性が骨を作る骨芽細胞の配列化により達成されることを発見し,健全骨に類似したコラーゲン/アパタイト配向化骨基質の早期誘導が,遅発性の術後感染の抑制に有効であると仮説を立て,これを人為的に誘導する材料を開発した。
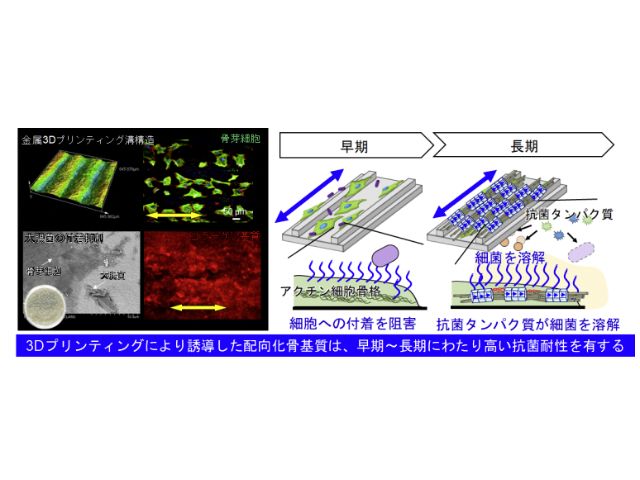
細胞制御のための微細構造の形成に欠かせない金属3Dプリンティングの技術を活用し,チタン合金基板表面におおよそ100μm幅の溝構造を作製し,細胞機能の検証にはマウス頭蓋冠由来の初代骨芽細胞の培養試験を実施した。
細胞培養後に大腸菌と共培養を行なうことで,細胞機能が細菌の付着や生存,増殖に与える影響を解明する実験系を構築した。溝構造上で骨芽細部が一方向配列化していることが実証され,さらに骨芽細胞が産生するコラーゲン基質も同方向へと配向化しており,生体骨と類似した配向化骨基質を再現することができた。
骨芽細胞と大腸菌の共培養モデルでは,培養後の大腸菌数を,寒天培地培養法を用いたコロニー数の計測により評価した。その結果,溝基板上で配向化した骨芽細胞は,大腸菌の付着を大幅に抑制することが見出された。
さらに長期の培養で骨を形成することで,大腸菌数を大幅に軽減することができる。骨基質配向化により大腸菌抑制を制御する因子の特定のために,共培養後の培地上清を回収し,骨芽細胞から産生された生物学的因子の産生量を定量評価した。
すると,抗菌タンパク質の一種であるβdefensin2および3が多く合成され,細胞外へと放出されていることが示された。これらの抗菌タンパク質は,細菌の細胞膜を溶解し,その感染機能を抑制する働きがある。今回の結果より,骨が本来もつ配向化基質が,高い感染抵抗性をもつことが世界で初めて明らかになった。
研究グループは,今回の成果は,骨基質配向化デバイスがこれまでの骨バイオマテリアルにはなかった早期の骨健全化とすぐれた感染抵抗性をあわせもつことから,実用的には医療デバイスの高機能化に貢献するとしている。
すでに同グループの開発した埋入初期から骨基質の配向化誘導を可能とする脊椎スペーサが大規模臨床応用されており,こうした関連デバイスにとって術後の感染抑制が強く期待されるとしている。