 大阪公立大学の研究グループは,光の力でがん細胞由来ナノ粒子の効率的な検出に成功した(ニュースリリース)。
大阪公立大学の研究グループは,光の力でがん細胞由来ナノ粒子の効率的な検出に成功した(ニュースリリース)。
研究グループの従来の光濃縮検出研究では,光の力で捕捉した金属ナノ粒子集合体の発熱効果による対流でDNAの二重鎖形成の光誘導加速に成功しており,さらに抗原抗体反応のマイクロフロー光誘導加速による微量検出にも成功している。
しかし,エクソソームなどのナノスケールの細胞外小胞(EV)は光の波長より小さく,光圧の作用も弱く,発熱効果による対流を用いた場合には熱的ダメージも懸念され,微量検出にこれらの方法論が使えるかどうかはこれまで不明だった。また,夾雑物を多く含む細胞上清に適用できるかどうかも未解決の重要課題だった。
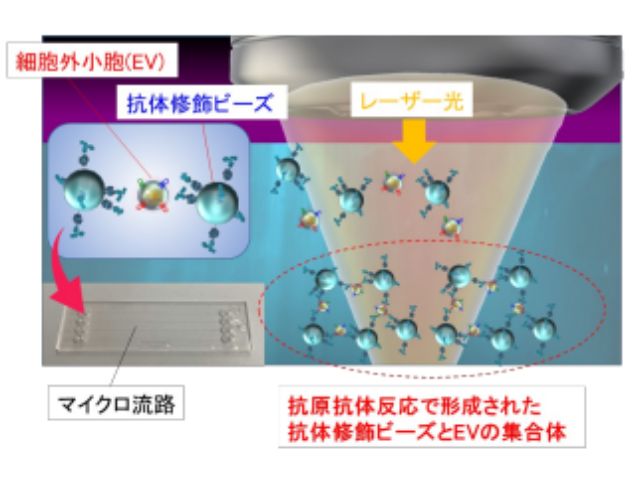
研究グループは,大腸がん細胞株および肺がん細胞株から分泌されたEVを標的として,それぞれのEV表面の複数種類の膜タンパク質の各々と特異的に結合する抗体を修飾した直径2μmのビーズを幅100μm程度のマイクロ流路中に一定流量で導入し,レーザー照射により生じる光圧による濃縮・集積化を行なった。
さらに,マイクロフロー光濃縮により形成された抗体修飾ビーズとEVの集積構造の光学透過像を観察し,全集合面積に対する多層部分の面積の割合を,レーザースポット位置を変えて測定し,スポット位置65μm下方の時が最も高い直線性が得られることを確認した。
また,同じスポット位置で共焦点光学システムを用いて3次元解析を行なったところ,EV量と立体的な集積構造の側面から見た場合の面積もEV濃度と正の相関を示すことを明らかにした。これらの結果は,レーザースポット位置を変化させることで光誘起力の強さを変調し,検量線の直線性と誤差を制御できる可能性も示している。
従来法であるELISAよりも1~2ケタの高感度化に成功し,500nLの液体試料中のわずか103-104個のナノスケールEVを5分以内に検出することに成功した。さらに,EV表面の膜タンパク質に特異的に結合する2種類の抗体修飾ビーズを用いて,大腸がん細胞由来EVのマイクロフロー光濃縮検出したところ,各EV表面の膜タンパク質の種類と発現量を検量線から識別できる可能性も示唆した。
この技術が,今回明らかにした大腸がん細胞株や肺がん細胞株由来のナノスケールEVだけでなく他の種類のがん細胞にも適用可能で,さらに,認知症マーカータンパク質がEVに含まれるとの報告もある。研究グループは,認知症マーカーやEVと同サイズのウイルスなどへの適用可能性も期待できるとしている。