 金沢大学と生理学研究所は,脳内の記憶形成や忘却に関わる酵素“カルシウム/カルモジュリン依存性キナーゼ II(CaMKII)”の入力依存的な構造変化(活性化)を,高速原子間力顕微鏡(高速AFM)を用いて,ナノメートルスケールで可視化することに成功した(ニュースリリース)。
金沢大学と生理学研究所は,脳内の記憶形成や忘却に関わる酵素“カルシウム/カルモジュリン依存性キナーゼ II(CaMKII)”の入力依存的な構造変化(活性化)を,高速原子間力顕微鏡(高速AFM)を用いて,ナノメートルスケールで可視化することに成功した(ニュースリリース)。
神経細胞と神経細胞をつなぎ,情報を伝える部位であるシナプスの変化が,記憶や学習,またこれらに関係した神経疾患と深い関係があることが明らかになってきている。
例えば,シナプスの体積や各種受容体が増えることで,長期的に情報伝達効率が向上することが分かっている。このような伝達効率の変化は,長期増強(LTP)と呼ばれ,記憶形成や維持に関与すると考えられている。一方で,シナプス体積や受容体の減少は長期抑制(LTD)と呼ばれ,記憶の忘却に関与すると考えられている。
LTPやLTDなどのシナプスの可塑性には,カルシウム/カルモジュリン依存性キナーゼ II(CaMKII)とよばれる酵素が重要な役割を果たすが,細胞内のような溶液環境でのその振る舞いは分かっておらず,多くの謎が残されていた。
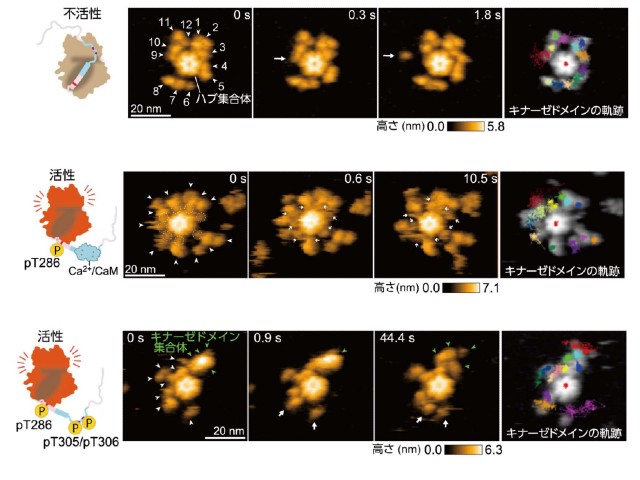
研究では,脳内の記憶形成や忘却に関わる酵素“カルシウム/カルモジュリン依存性キナーゼ II(CaMKII)”の入力依存的な構造変化(活性化)を,高速原子間力顕微鏡(高速 AFM)を用いて,3種(ラット,ヒドラ,線虫)のCaMKII の構造ダイナミクスを,ナノメートルスケールの空間分解能で直接可視化することを試みた。
その結果,脳の神経細胞に豊富に存在し,記憶形成や忘却を担うタンパク質(CaMKII)のはたらく姿をナノスケールで詳細に明らかにした。また,ヒドラや線虫のCaMKIIと比較して,ラット由来のCaMKIIだけが自己リン酸化による触媒ドメイン集合体を形成することが分かった。
さらに,ヒドラや線虫のCaMKIIと比較して,ラット由来のCaMKIIは脱リン酸化酵素により強い耐性を持っていることも分かった。種依存的なCaMKII構造の違いや薬剤に対する応答メカニズムは,将来,記憶や学習,認知といった脳機能を分子レベルで理解することにつながるという。
研究グループはこの成果について,アルツハイマー病をはじめとするさまざまな精神・神経疾患の臨床応用(治療薬)に繋がることが期待されるものだとしている。