 東北大学の研究グループは,細胞内の微小で速い温度変化を逃さず観測できるマイクロ温度センサシステムを開発し,単一細胞における熱伝導率と比熱を定量的に評価することに成功した(ニュースリリース)。
東北大学の研究グループは,細胞内の微小で速い温度変化を逃さず観測できるマイクロ温度センサシステムを開発し,単一細胞における熱伝導率と比熱を定量的に評価することに成功した(ニュースリリース)。
生物は周囲の環境に対して適切に応答することで恒常性を保っている。それは細胞も同様で,数十マイクロメートル(µm)の大きさであるにも関わらず一つのシステムとして,周囲の環境や自身の状況に応じて生体的な反応を示す。
温度変化は熱収支の結果であり,細胞の温度変化を追うことで,その内部で何が起きているかを知ることができる。しかし単一細胞においては,熱物性の計測すら困難で,比熱の値はいまだに明らかになっていなかった。
現在,単一細胞の熱解析では蛍光ナノ粒子を用いて光学的に細胞内温度変化を計測する手法が主流だが,温度分解能と時間分解能の両立が困難であったり,プローブであるナノ粒子の吸熱による影響が大きく表れたりすることがあった。
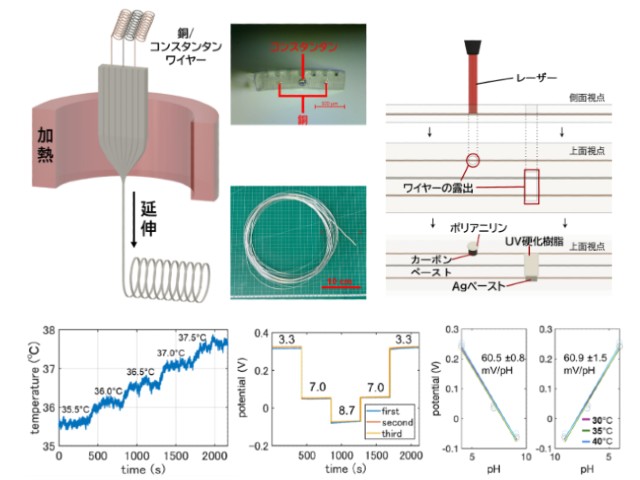
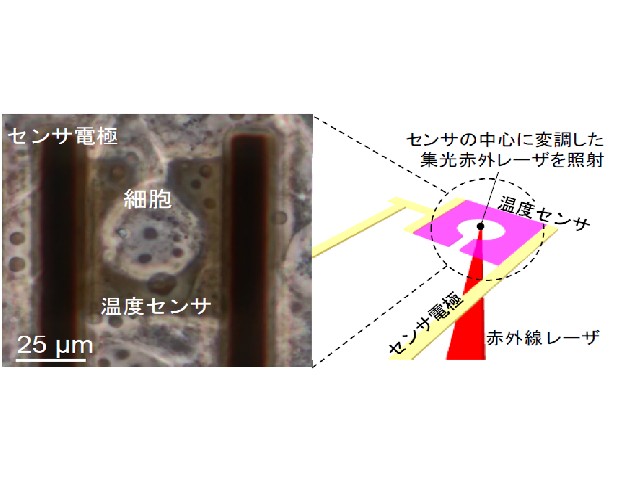
そこで研究グループは,温度によって電気抵抗が大きく変わる酸化バナジウムを微細加工技術を使って加工し,細胞一つと同じ大きさ50µmのマイクロ温度センサ(マイクロサーミスタ)を作製した。
センサを含むデバイス上面に細胞を培養し,センサ上に位置した単一細胞に対して赤外線レーザーを照射して温度変化計測を行なった。デバイス全体の温度(細胞周囲の温度)および細胞内における非常に狭い範囲(数µmの範囲)の温度を周期的に変えた時(0.25,0.6,3.0Hzの周波数)に,細胞の温度応答がどのような挙動を示すか観測した。
その結果,単一細胞における熱伝導率と比熱を定量的に評価することに成功した。細胞にとって適温である37℃では,熱伝導率および比熱は加熱周波数に依存する一方,周囲温度が25℃の時は加熱周波数に関わらず熱伝導率および比熱は水と同程度の値になったことを明らかにした。
この熱的な特性は細胞内反応を支配するエネルギー流や細胞内の温度恒常性の理解に必須であり,研究グループは,これらの詳細や機構の理解を通じて,細胞機能の基本原理の解明が期待できるとする。
さらに長期的には,ミトコンドリア病をはじめとする細胞レベルで生じる難病の原因究明や創薬研究における細胞レベルでの詳細かつ短時間の効能評価など,医療面での貢献も期待できるとしている。