 東京医科歯科大学の研究グループは,新たなアプローチでオートファジーを可視化する手法を開発した(ニュースリリース)。
東京医科歯科大学の研究グループは,新たなアプローチでオートファジーを可視化する手法を開発した(ニュースリリース)。
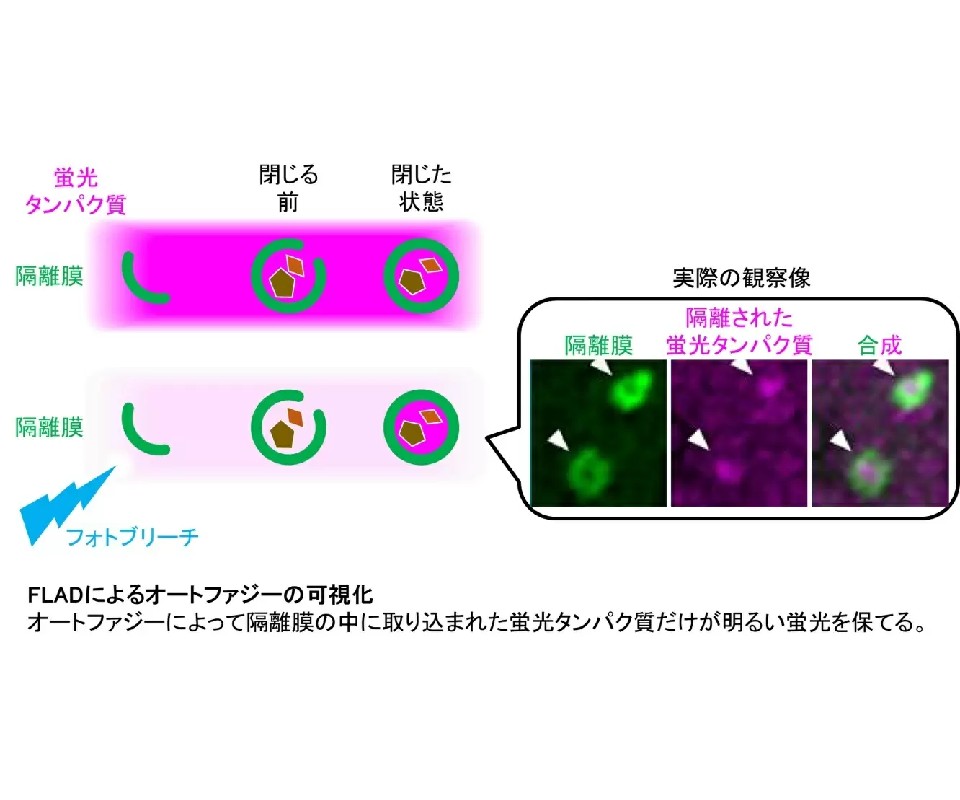
細胞がオートファジーによって自己成分を分解する際,分解したいものだけを隔離膜と呼ばれる膜で包んで隔離する隔離機構の解明が重要な課題となっている。隔離膜は餃子の皮のような形状をしており,分解標的を包み込むように形態変化する。
これまでは隔離膜が隙間なく閉じているか評価することで隔離が完了したのかを判断していたが,最小で10nm以下の非常に小さな分子を隔離する場合もあり,超高性能な顕微鏡でも10nm以下の穴の有無は困難だった。
そこで研究グループは,隔離膜ではなく包まれる内包物に着目。極小の蛍光分子を隔離膜内に入れ,蛍光分子が漏れ出ていないことで隔離膜に穴が開いておらず,しっかりと閉じた構造になっていることを証明する実験系の構築を目指した。
研究では,隔離させる極小分子としてGFPやRFのような蛍光タンパク質に着目。これらの蛍光タンパク質は自身だけの状態では細胞内で特殊な応答などはせずに細胞中に一様に存在できる。研究グループはこの蛍光タンパク質単体での性質を鑑み,隔離膜の中にも存在するのではないかと考えた。
隔離膜に包み込まれた蛍光タンパク質と,それ以外の蛍光タンパク質を区別するためにフォトブリーチの手法を用い,細胞内を自由拡散できる,隔離膜に包まれていない蛍光タンパク質だけを消光すると,狙い通りにオートファジーによって隔離された蛍光タンパク質を可視化することに成功した。
蛍光タンパク質の大きさは10nm以下であるため,これらの蛍光が漏れ出さずに隔離されているという結果から隔離膜がきちんと閉じていることを証明し,この手法をFLAD(FLIP-based autophagy detection)と命名した。
抗がん剤などのDNA損傷ストレスによって誘導される新規オートファジーは従来型のオートファジー制御分子とは全く異なる分子群によって制御されることが知られており,既知のオートファジーマーカー分子も活用できないために研究が困難な状況だった。
研究グループは,新規オートファジーを誘導した際にも蛍光タンパク質が隔離される様子を検出することに成功し,FLADが今まで検出できていなかった様々なオートファジーの検出が可能なことを証明した。
また,FLADと従来型のオートファジー可視化手法を併用することで,2種類のオートファジーの活性化状況が,オートファジー誘導ストレスの種類によって異なる割合で誘導されていることも明らかにした。
この成果によって簡便に一般的な顕微鏡設備で隔離膜の膜動態をナノスケールで解析することが可能になった。研究グループは,隔離膜動態の研究が加速することが期待できるとしている。