 大阪公立大学の研究グループは,生体中の分子認識機構の一種である抗原抗体反応の光誘導加速に関する新原理を発見した(ニュースリリース)。
大阪公立大学の研究グループは,生体中の分子認識機構の一種である抗原抗体反応の光誘導加速に関する新原理を発見した(ニュースリリース)。
多くの疾患の早期診断法の一つとして,抗原抗体反応に基づく検査法(イムノアッセイ)による微量タンパク質の分析が重要な役割を果たしている。しかし,タンパク質はDNA検査で用いられるPCR法のような増幅が困難であり,インキュベーション(抗原抗体反応を静置して待つ工程)や洗浄など複雑な処理が必要かつ,熱に弱いという課題があった。
従来からさまざまな検出法が考案されているが,たとえば新型コロナウイルス感染症の抗原検査などに用いられる汎用的なイムノクロマト法では感度が低く,研究現場で用いられるELISA法(酵素結合免疫吸着法)は高感度ではあるものの工程数が多く,全工程で5~6時間を必要としていた。
また,研究グループによる従来の光濃縮の研究では,光の力で捕捉した金属ナノ粒子集合体の発熱効果による対流と圧力駆動流による補助の下,5~10分の短時間でフェムトグラムオーダーの微量タンパク質の計測に成功していたが,熱によるタンパク質の変性が課題だった。
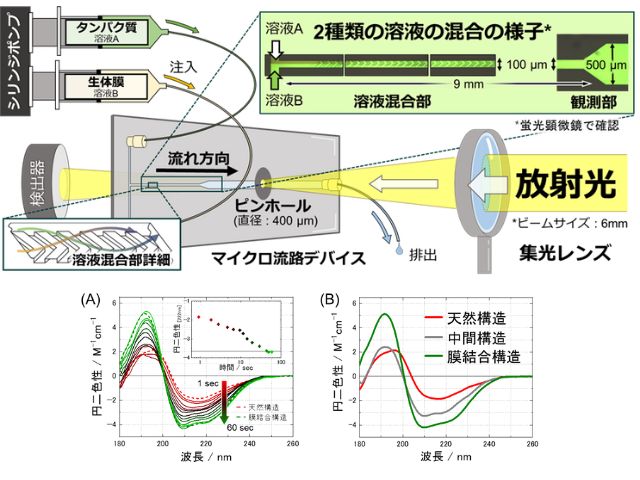
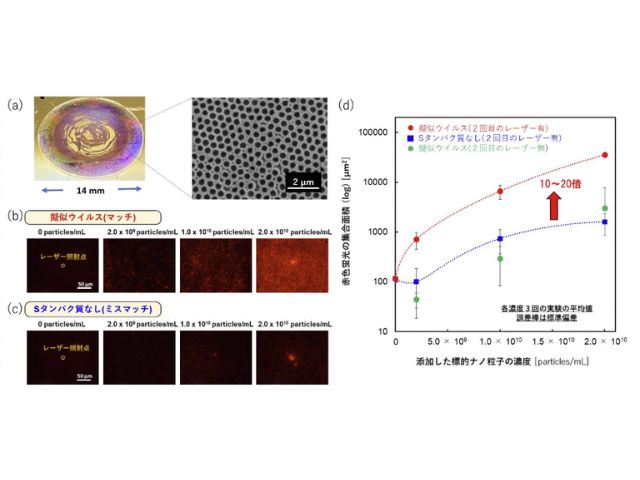
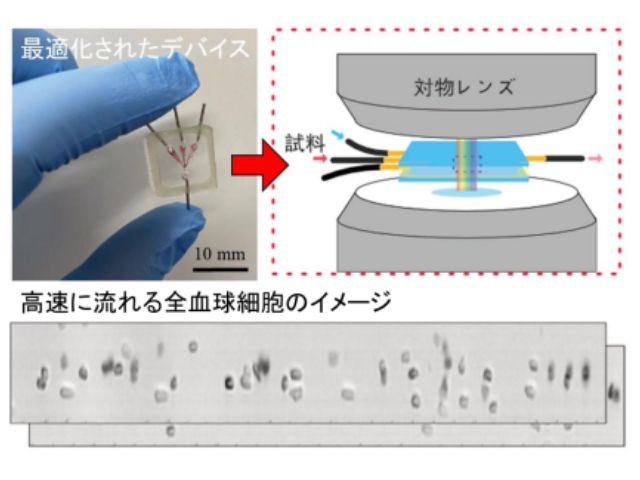
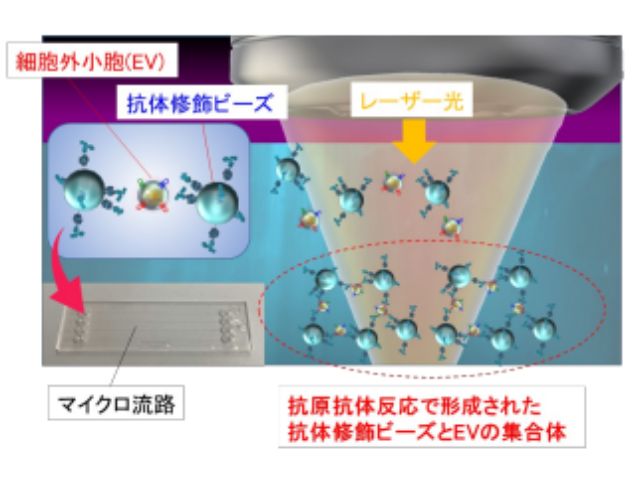
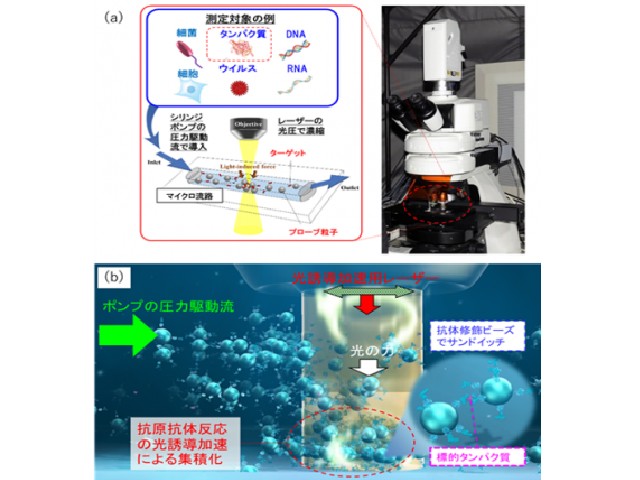
今回研究では,標的タンパク質とこれに選択的に結合する抗体を修飾したプローブ粒子を人間の毛髪や細動脈と同程度の100μm程度の幅の流路に導入し,同程度のスポット径70μm程度にデフォーカスした数百mW程度の赤外レーザー光を3分間照射することで,従来のタンパク質検査技術の約100倍の高感度の検出を可能とし,数十アトグラムレベルでの迅速微量計測に世界で初めて成功した。
具体的には,赤外光吸収による熱発生が少なく光散乱が強い直径2μmのポリマービーズを用いて光の力の成分である「散乱力」を増強し,圧力駆動流でスポットに誘導された抗体修飾ビーズと標的タンパク質に熱的ダメージを与えずに集積する光誘導加速の新原理を提案した。
今回計測した最小濃度0.31pg/mLのタンパク質分散液の場合,濃度と測定領域を通過した液量(300nL)から換算して46.5ag(約2600個),つまり2京分の1グラムの標的タンパク質をわずか3分間で計測できたことに相当する。
研究グループはこの成果について,1滴の血液など微量の体液から,がん・認知症・微生物感染症などに関連する物質の検出や新規疾患マーカーの発見を促進し,さまざまな病気の超早期診断システムの開発にブレークスルーを産み出す可能性を示唆するものだとしている。