 京都大学と大阪大学は,無制限の多重染色が可能な超解像顕微鏡IRISのための蛍光プローブを,既存の抗体を改造することによって迅速に作製する方法を開発した(ニュースリリース)。
京都大学と大阪大学は,無制限の多重染色が可能な超解像顕微鏡IRISのための蛍光プローブを,既存の抗体を改造することによって迅速に作製する方法を開発した(ニュースリリース)。
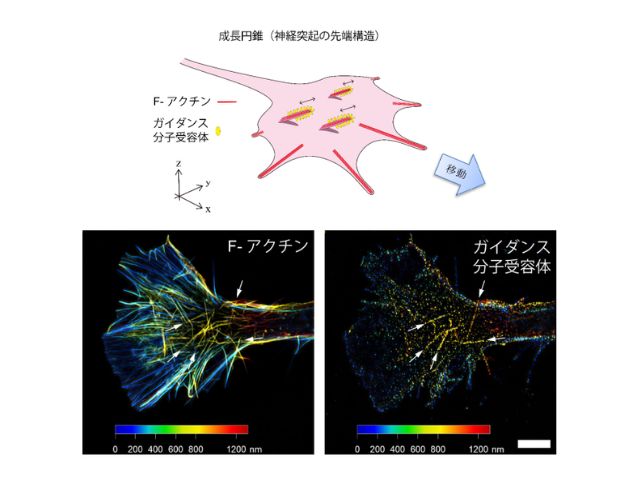
可視化対象分⼦に対し迅速に結合解離を繰り返す蛍光プローブを⽤いる超解像顕微鏡IRISは,通常の抗体染⾊では不可能な⾼密度で⾼精細な分⼦分布画像を作る。しかし,個別の観察対象に対するプローブを作るのに⼿間がかかることが問題だった。
研究では,既に特異性や免疫染⾊における有⽤性が証明されているモノクローナル抗体を改変し,IRISに必要な抗原から迅速に解離するリコンビナント蛍光プローブに変換する⽅法の樹⽴を試みた。
まず,抗体の抗原認識部位であるFv領域の性質を保持したまま,⾼いタンパク質⽣産性を実現するFv-claspと呼ばれる⼩型化フラグメント抗体フォーマットを採⽤した。これに蛍光タンパク質を融合することで,アミノ酸配列の改変体を数多く作ることができ,蛍光単分⼦イメージングによって解離速度を効率よく評価できた。
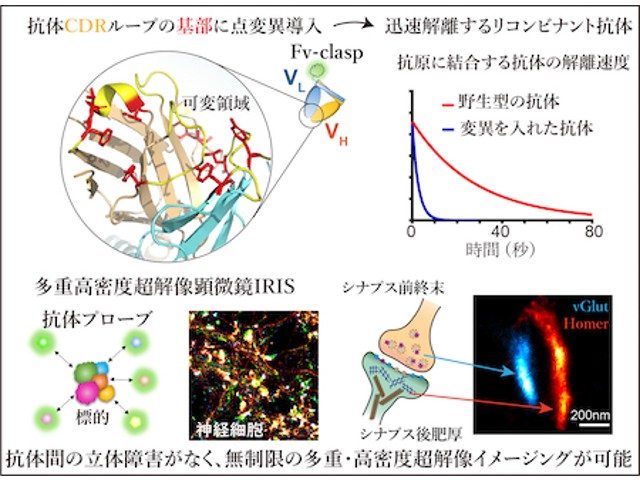
抗体のFv領域には,相補性決定領域(CDR)と呼ばれる多様性に富む配列が重鎖・軽鎖にそれぞれ3カ所ずつ有り,抗原との接触⾯を形成する。⼀般に親和性を変化させたい場合,直接相互作⽤するアミノ酸に変異をいれる。しかし,抗原と抗体断⽚との共結晶構造が報告されている場合を除き,抗原と直接相互作⽤するアミノ酸は分からない。
そこで,Fv領域に保存されたアミノ酸のうち,Fv領域の構造を保つフレームワーク領域からは外れており,CDRの形状には影響を与える可能性が⾼いものがあることに着⽬した。
選別されたアミノ酸の変異を複数組み合せることによって,Fv-clasp断⽚の抗原からの解離が数倍〜数百倍速くなり,解離の半減期を数秒以内にまで速めることに成功した。抗原との接触⾯の中⼼にあるアミノ酸を改変しないため,⾼い確率で結合特異性が保たれるのがこの方法の⻑所だという。
さらに,ラクダ科の動物が産⽣する重鎖のみからなる⼩型抗体ナノボディーでも,同様のアミノ酸を検索し,それらの変異を組み合わせることで,IRISに適した迅速解離型の蛍光プローブに転換できることを確認した。
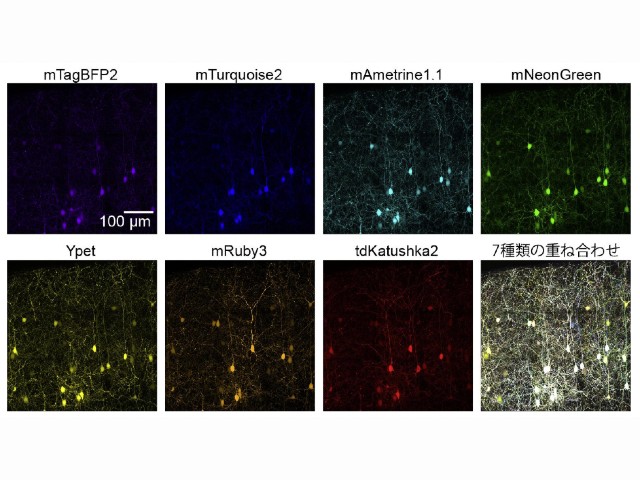
これらの得られた蛍光プローブを⽤いたIRISは,4ないし7重の多重超解像染⾊を実現するのみならず,従来の超解像顕微鏡では実現されない忠実度の⾼いイメージングに成功したという。
研究グループは,1細胞あたり数万〜数100万個存在する蛋⽩質のほとんど全ての位置を可視化し,多種類の分⼦間で⽐較できる顕微鏡の実⽤化が期待されるとしている。