 北陸先端科学技術大学院大学(JAIST)と量子科学技術研究開発機構は,液体金属に生体分子を吸着させた複合体へのガンマ線照射によりコア-シェル型の構造を持つナノ粒子の作製に成功し,このナノ粒子がEPR効果により腫瘍に集積し,マウスに移植したがんの可視化と,レーザーの光熱変換によるがん治療が可能であることを実証した(ニュースリリース)。
北陸先端科学技術大学院大学(JAIST)と量子科学技術研究開発機構は,液体金属に生体分子を吸着させた複合体へのガンマ線照射によりコア-シェル型の構造を持つナノ粒子の作製に成功し,このナノ粒子がEPR効果により腫瘍に集積し,マウスに移植したがんの可視化と,レーザーの光熱変換によるがん治療が可能であることを実証した(ニュースリリース)。
ガリウム・インジウム(Ga/In)合金からなる室温で液体の金属(液体金属)は,高い生体適合性と優れた物理化学的特性を有し,ナノ粒子化した液体金属のバイオメディカル分野応用に注目が集まっている。
研究グループは,液体金属をがん患部に送り込むことができれば,生体透過性の高い近赤外レーザー光を用いることで,患部の可視化や光熱変換を利用した,新たながんの診断や治療が実現できるのではないかと考えた。
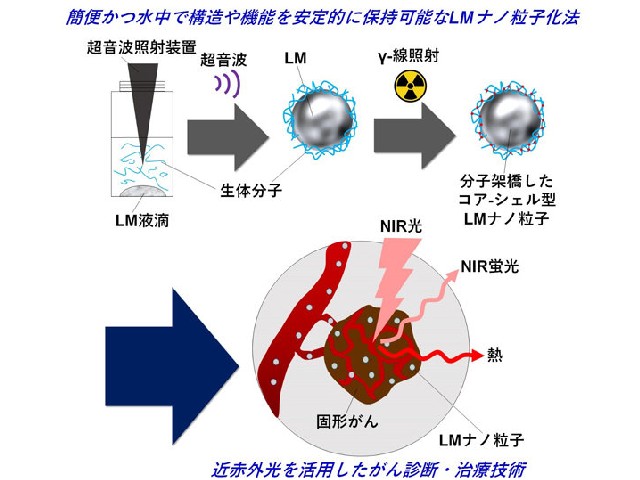
液体金属をナノ粒子化するには煩雑な合成プロセスが必要であり,ナノ粒子化した液体金属の構造や機能を溶媒中で安定的に保持させることは難しい。そこで,研究グループは,液体金属をがん患部まで送り,がん細胞内に取り込ませるために,液体金属表面に生体高分子(ゼラチン,DNA,レシチン,血清蛋白質)を吸着させたコア-シェル型ナノ粒子の作製を試みた。
Ga/In液体金属と生体分子の混合物に超音波照射することで,コア-シェル型ナノ粒子を形成できることを見出したが,そのままではナノ粒子の構造を水中で安定的に維持させることはできなかった。
そこで,ナノ粒子表面の生体高分子がバラバラにならないよう,量子ビーム(ガンマ線)架橋反応を利用した。この方法でガンマ線架橋したゼラチン-液体金属ナノ粒子は,30日以上の粒径安定性を有していること,細胞に対し高い膜浸透性を有し毒性が無いこと,近赤外レーザー光照射により発熱が起こることが確認できた。
大腸がんを移植したマウスに,ゼラチン-液体金属ナノ粒子を投与し,4時間後に740~790nmの近赤外光を当てたところがん患部だけが蛍光を発している画像が得られ,このナノ粒子がEPR効果によりがん組織に取り込まれていることが分かった。そこで,当該ナノ粒子が集積した患部に対して808nmの近赤外レーザー光を照射したところ,光熱変換による効果で26日後には,がんを完全に消失させることに成功した。
さらに,ゼラチン-液体金属ナノ粒子の細胞毒性と生体適合性を評価した結果,細胞毒性はなく,生体に与える影響は極めて少ないこともわかった。研究グループは,この技術が革新的がん診断・治療法だけでなく,幅広い研究領域における材料設計の技術基盤になるとしている。