 名古屋大学と蘭グローニンゲン大学は,概日時計を調節するキナーゼ阻害剤に,光で構造が変化する「光スイッチ」を組み込んだ化合物を開発し,哺乳類の細胞が示す概日リズムを光によって自在に操作することに成功した(ニュースリリース)。
名古屋大学と蘭グローニンゲン大学は,概日時計を調節するキナーゼ阻害剤に,光で構造が変化する「光スイッチ」を組み込んだ化合物を開発し,哺乳類の細胞が示す概日リズムを光によって自在に操作することに成功した(ニュースリリース)。
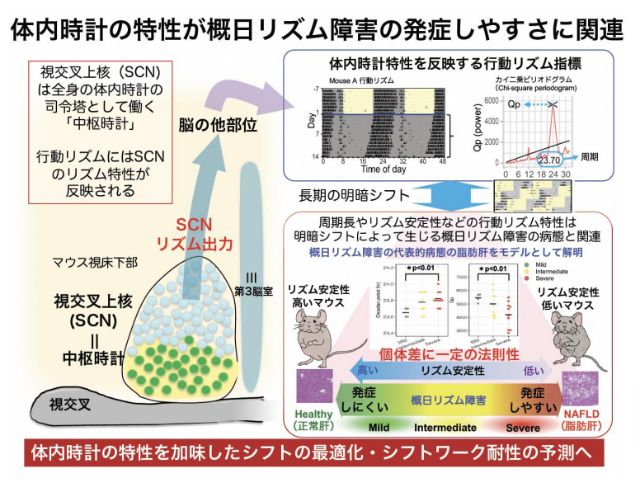
体のリズムを司る仕組みである「概日時計」は,時計遺伝子ならびに時計タンパク質の相互作用によって構成されるが,1日という長い周期で,どのように安定して時を刻むことができるのか,その仕組みは明らかでない。
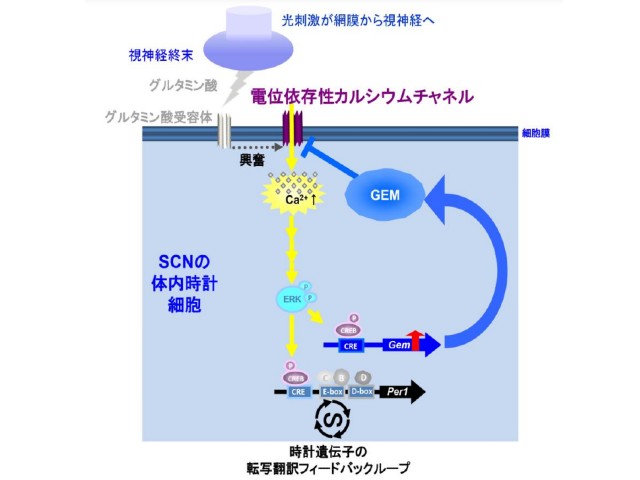
研究グループはこれまで,1日周期の決定に関わる重要な分子機構のひとつとして,概日リズムの周期を強力に延長する化合物であるLongdaysinが,概日時計が働くために必要な遺伝子とタンパク質をリン酸化して分解に導く作用をもつ,タンパク質キナーゼのCKIの機能を阻害することを明らかにしている。
複雑な時計システムの全体像を解明していくには,狙ったタイミングと場所で概日時計を操作する技術が必要となる。そこで研究グループはLongdaysinを用いて,光を用いて化合物の活性を時空間的に操作する,光薬理学による概日リズムの自在な制御を試みた。
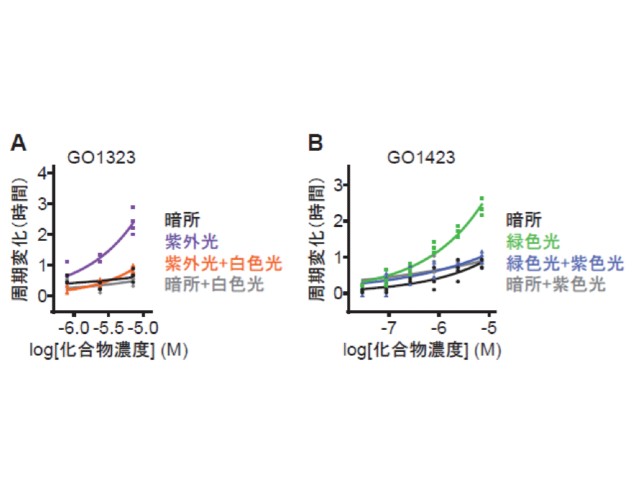
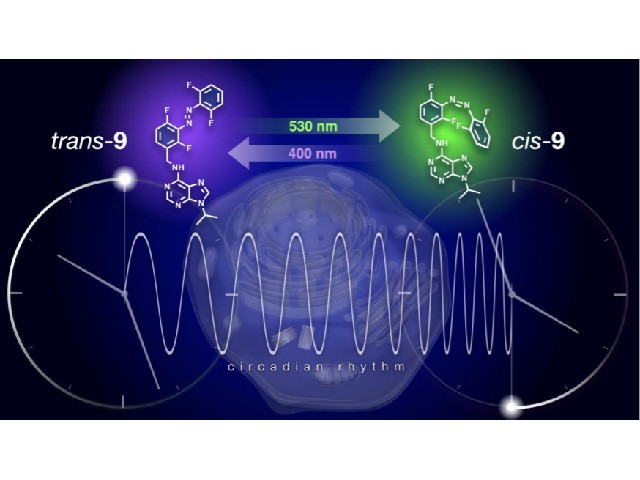
アゾベンゼンは光薬理学において光スイッチとしてよく用いられる分子で,紫外光によってトランス体からシス体に,白色光によってシス体からトランス体に構造変化する。しかし,可逆的な機能操作を可能にするためには,一般的にアゾベンゼンのシス体の安定性は低く,光を当ててもすぐにトランス体に戻ってしまうため,概日リズムのような長時間スケールの生命現象への応用は困難であると考えられていた。
研究グループは,時計キナーゼであるCKIの阻害剤に光スイッチとしてアゾベンゼンを導入したところ,この化合物は光に応答してCKIの機能を可逆的に阻害し,哺乳類細胞の概日リズムの周期と時刻を光によって自在に操作することに成功した。実際にこの化合物を用いた実験では,概日リズムの時刻を約5時間も遅らせることに成功した。
この成果は,今後,時間的だけでなく空間的な制御に適用することにより,多細胞からなる概日時計システムの複雑な細胞間相互作用ネットワークを解析するための有用なツールになると期待されるという。研究グループでは,睡眠相前進症候群のような疾患や,現代社会におけるシフトワークなどによる時差ボケの解消への応用も,将来的に期待される成果だとしている。