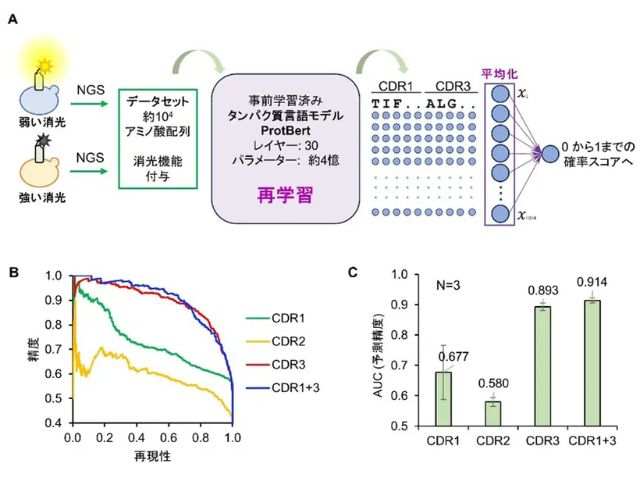
 大阪大学の研究グループは,pH4.5~9.0の細胞環境で安定して蛍光する,耐酸性の光スイッチ型緑色蛍光たんぱく質「rsGamillus」の開発に成功した(ニュースリリース)。
大阪大学の研究グループは,pH4.5~9.0の細胞環境で安定して蛍光する,耐酸性の光スイッチ型緑色蛍光たんぱく質「rsGamillus」の開発に成功した(ニュースリリース)。
超解像顕微鏡法は,生きた細胞内の生体分子の局在や動態を,光の回折限界(~300nm)を超えた解像度を実現する方法で,観察対象である生体分子を標識するための蛍光タグと,特殊な照明パターン(スキーム)を組み込んだ顕微鏡の2つが必要となる。
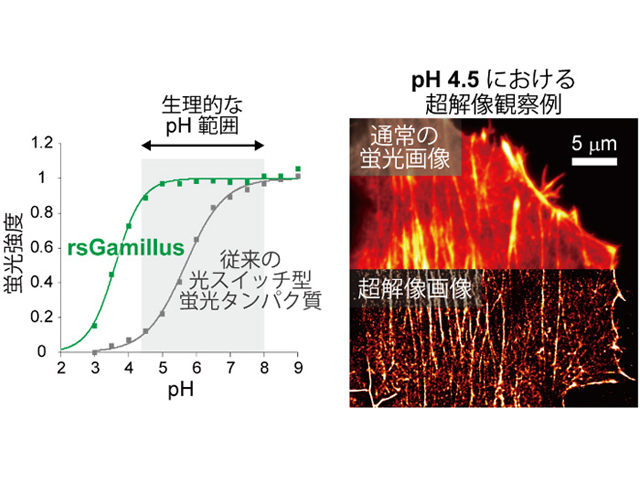
光スイッチ型の蛍光たんぱく質をタグとして用いる超解像法は,たんぱく質を簡便に標識でき,細胞に対する毒性も比較的小さいことから,幅広く利用されている。しかし,現在報告されている光スイッチ型の蛍光たんぱく質の多くは,pH5~6以下の酸性環境で消失するといった問題点がある。従って,酸性細胞小器官の細かい動態や,酸性細胞環境中の微小構造を調査するためにも,耐酸性で緑色の蛍光たんぱく質が強く求められていた。
研究グループは昨年,日本産ハナガサクラゲの光る触手から,pH4.5~9.0の細胞環境で安定して蛍光する耐酸性の緑色蛍光たんぱく質「Gamillus」を開発し,その蛍光・非蛍光状態が光刺激により可逆的に切り替わること(光スイッチ),そのメカニズムが蛍光発色団のtrans-cis異性化並びにフェノール水酸基のプロトン化/脱プロトン化であることを見いだした。このメカニズムを基にした分子設計,遺伝子変異導入により,光スイッチのコントラストを向上させた変異体「rsGamillus」を開発した。
現在までに報告されている可逆的光スイッチ蛍光たんぱく質が全てpH5~6以下の酸性環境で蛍光を失うのに対し,rsGamillusは酸性環境でも安定した蛍光を放ち,細胞内のほぼ全てのpH環境で使用可能なことが分かった。人工的に模した細胞酸性環境中(pH4.5)で、1分子蛍光の輝点重心位置の計測に基づく超解像顕微鏡観察に応用できることを証明した。酸性細胞小器官は多くの生命機能に密接に関わっているが,既存の光スイッチ型の蛍光たんぱく質は,低pHで蛍光しないため,酸性細胞小器官内での使用が限られていた。
研究グループは,rsGamillusが酸性環境中の未知の生命現象を発見するための基盤技術となり,医学・創薬研究にも大きく貢献するとしている。