東京医科歯科大学は,名古屋市立大学,東邦大学,北里大学,国立成育医療研究センター,山梨大学と共同で,光刺激によって体内時計が形成される仕組みを明らかにした(ニュースリリース)。
体内時計は多様な生理機能に24時間の周期変動を作り出す装置。「光を利用し自然界の昼夜の変化に対し体内環境を最適化する」という重要な役割を担っている。体内時計は,生物個体の細胞に存在する遺伝子発現のネガティブフィードバックループ(細胞時計)が基本単位。体内時計の形成には,光刺激により複数の細胞時計が同じ時刻に同調することが必須となる。しかしながら,光刺激による体内時計の形成の分子機構はわかっていなかった。
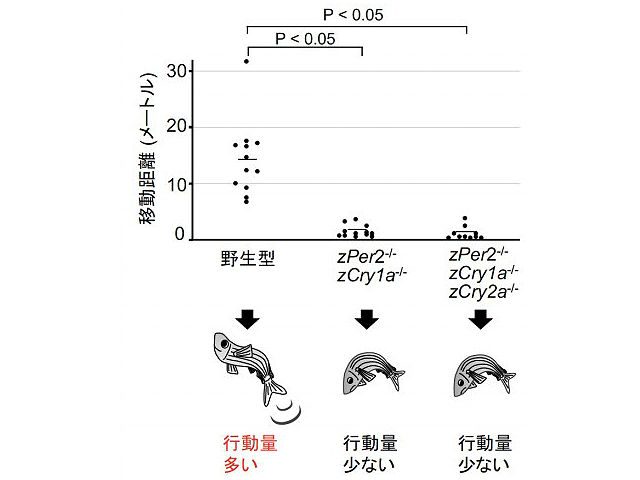
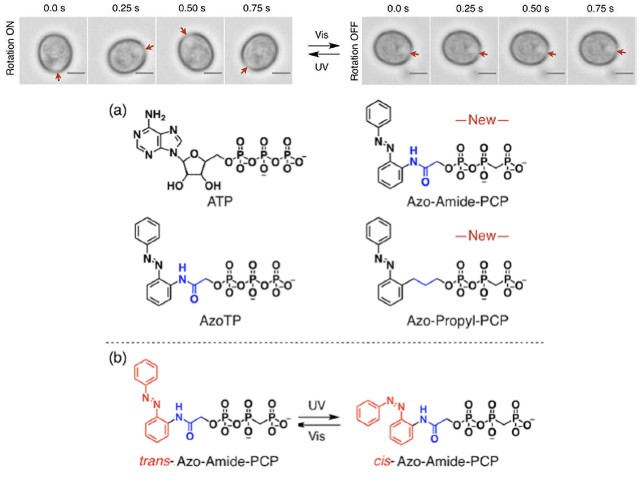
今回,研究グループは,分子生物学的な手法により,光誘導性の時計制御分子 zPer2, zCry1a, zCry2a をコードする遺伝子を破壊したゼブラフィッシュ(遺伝子改変ゼブラフィッシュ)を作出した。その結果,野生型ゼブラフィッシュと比較して,遺伝子改変ゼブラフィッシュでは行動量が低下することを見出した。
遺伝子改変ゼブラフィッシュでは,エネルギー代謝を調節する遺伝子群の発現パターンが変化し,エネルギーの源であるATP量が減少した。また,行動の日周変動を解析した結果,遺伝子改変個体では,光刺激による体内時計の形成が失われていることを見出した。この原因を解明するために,ゼブラフィッシュ胚由来の培養細胞を樹立し,レポーター遺伝子を導入し,細胞時計を可視化した。
その結果,野生型細胞では,異なる時刻を示した各細胞時計が光照射により同じ時刻に同調した。しかしながら,遺伝子改変細胞では,光照射によっても異なる時刻のままで同調しなかった。以上の結果は,光誘導性の時計制御分子が,「エネルギー代謝を通じて行動量を制御すること」「個体内の個々の細胞時計を同調させ体内時計を形成させること」を示唆しているとする。
研究グループは,今回の研究により,これまで不明であった細胞時計の光同調機構が分子レベルで明らかにし,光誘導性の時計制御分子がエネルギー代謝を通じて行動量を制御することを見出した。またこの研究は,体内時計障害を原因とする睡眠障害などの疾患の病因解明に貢献することが期待できるとしている。