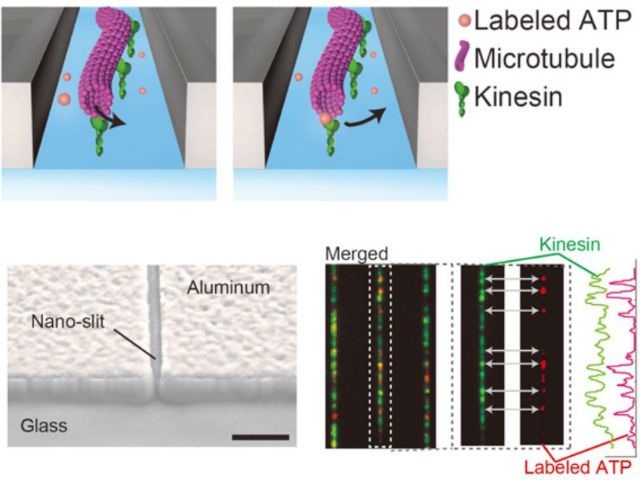
京都大学らは,分子科学研究所,青山学院と共同で,ナノ構造(ナノスリット)を用いてモータータンパク質であるキネシンとその運動に必要なアデノシン三リン酸(ATP)分子を同時に1分子観察する手法を開発した(ニュースリリース)。
これにより,キネシンにATP分子が一つずつ結合する様子をリアルタイムで観察することができるようになり,キネシンが微小管と結合している場合には,ATP分子との結合時間が変化することを明らかにした。
キネシンは細胞骨格を構成する微小管の上を運動することで,細胞小器官やタンパク質の輸送の原動力として働いている。観察対象に蛍光分子を結合させ,1分子ずつ蛍光観察する1分子蛍光観察法は,キネシンの運動機構を計測する手法として有力なもの。しかし,生体内と同程度の高いATP濃度の場合には背景光のノイズが大きくなり,1分子観察が不可能になるという制限があった。
このため,直径100nm程度のピンホールに光を閉じ込めることでノイズを抑制し,より高い濃度の1分子観察を行なう「Zero-ModeWaveguides」(ZMWs)と呼ばれるデバイスが開発されたが,フィラメント状の構造である微小管はピンホールに導入することが困難であり,ZMWsをキネシンの運動評価に利用することができなかった。
今回研究グループは,幅100nm程度のナノスリット内に光を閉じ込めて,1分子観察における背景光のノイズを抑制する新手法「Linear ZMWs」によって,蛍光ATPがキネシンに結合・解離する様子をリアルタイム観察した。これにより,微小管の有無によってATPがキネシンに結合している時間や頻度が変化していることを1分子で捉えることに成功したという。
具体的には,数値シミュレーションを利用してナノスリット構造に励起光が入射したときの光の分布を計算し,その結果に基づいてスリットの寸法を設計した。ガラス基板上のアルミ薄膜を電子ビームリソグラフィによって加工してナノスリットを製作し,このスリットがLinear ZMWsとして機能することを確認した。
その後,ガラス基板に固定したキネシン上を微小管が運動するグライディングアッセイと呼ばれる実験手法を用い,蛍光ATPが緑色蛍光タンパク質(GFP)を結合させたキネシンへと一時的に結合・解離する様子を1分子観察することに成功した。
研究グループは,今回の研究で確立した観察法は,キネシンだけでなく,ダイニンやミオシンなど他のモータータンパク質の1分子観察にも応用できるとし,この研究によって,モータータンパク質の運動機構について新たな知見を得ることが期待できるとしている。