 名古屋大学と,情報・システム研究機構国立遺伝学研究所は共同研究で,光を用いてヒトの内在性タンパク質の局在を自在に操作する技術を開発し,細胞分裂装置(紡錘体)の配置を光で操作することに世界で初めて成功した(ニュースリリース)。
名古屋大学と,情報・システム研究機構国立遺伝学研究所は共同研究で,光を用いてヒトの内在性タンパク質の局在を自在に操作する技術を開発し,細胞分裂装置(紡錘体)の配置を光で操作することに世界で初めて成功した(ニュースリリース)。
紡錘体の配置は細胞分裂の方向や娘細胞のサイズを決めるため,母細胞2つの同じ娘細胞に分裂するのか,それとも2つの異なる娘細胞に分裂するのかを決める重要な役割を担う。従って,紡錘体を適切に配置する仕組みは,私たちの体を作る基礎となるが,どのようにして紡錘体を動かす力が生み出されるのかは,理解されていなかった。
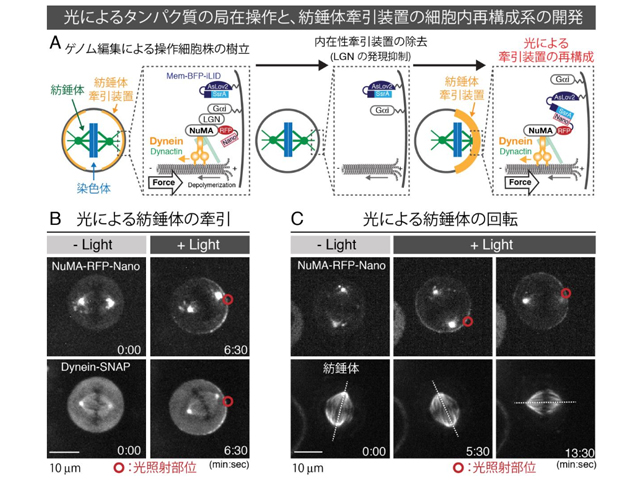
研究グループは,光誘導式ヘテロ2量体形成ツール(iLID)とCRISPR/Cas9によるゲノム編集技術を組み合わせることにより,任意のヒトの内在性タンパク質の局在を自在に操作する技術の開発に成功した。さらに,この技術を内在性の牽引装置の除去と組み合わせることにより,人為的に紡錘体牽引装置の一部を細胞膜上に再構成し,それらの紡錘体牽引能力を評価できる実験系を開発し,紡錘体を引っ張る力を生み出すモデルを提唱した。
これまでの細胞生物学の中心は,標的タンパク質を壊して,その異常を解析することにより,タンパク質がもつ機能の必要性を理解することだった。近年,試験管内で特定のタンパク質(複合体)を精製し,その機能を直接理解する試みも報告されているが,紡錘体のような数百以上のタンパク質からなる巨大な構造を標的にした試験管内再構成は技術的な限界がある。
しかし,今回,光を用いタンパク質の局在を操作し,機能的な構造体を細胞内で再構成することにより,操作子の機能の十分性を理解することに成功した。この方法は,原理的には任意のタパク質に応用可能なので,様々なタンパク質の機能の十分性を生きた細胞の中で理解することが可能になるという。
また,これまで細胞分裂の方向性や娘細胞のサイズ,位置を光を用いて自在に操作する方法はなかった。今回開発した方法を用いれば,原理的には組織中の細胞であれ,任意の細胞を1細胞レベルで操作することが可能。今回開発した方法を改良することにより,今後は生体内での細胞分裂の対称性・非対性の制御の仕組みやその意義,また,それらの破綻と疾患との関連について,分子的な理解が進むとしている。