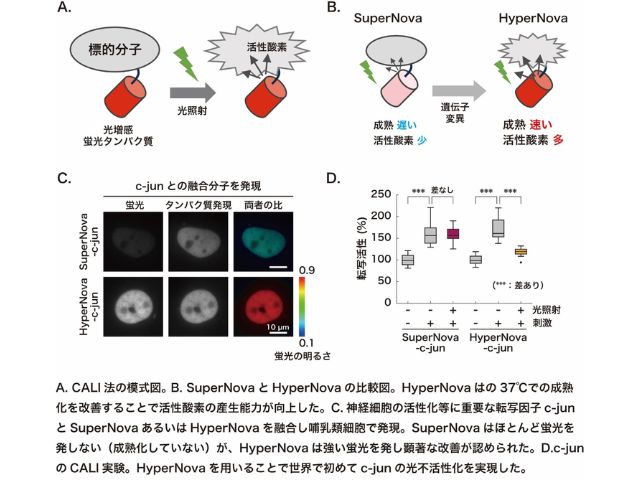
 沖縄科学技術大学院大学(OIST)は,ヒト疾患研究のモデルとして優れているゼブラフィッシュを用いて,突然変異による視力障害の一種であるレーバー先天性黒内障(LCA)における視細胞変性メカニズムの一端を明らかにした(ニュースリリース)。
沖縄科学技術大学院大学(OIST)は,ヒト疾患研究のモデルとして優れているゼブラフィッシュを用いて,突然変異による視力障害の一種であるレーバー先天性黒内障(LCA)における視細胞変性メカニズムの一端を明らかにした(ニュースリリース)。
新生児は,ゲノム上の損傷や遺伝子突然変異により視力障害をきたし,先天性失明を発症するリスクを持っていることがある。LCAは小児の失明で最も一般的な原因として挙げられ,視力障害全体の5%近くを占めている。この疾患は,両親が保有する眼の発生に関わる遺伝子に機能欠損が起きている場合,子供にも遺伝的に引き継がれ,発症に至るケースが知られている。しかし,LCAの病態の背景となる分子メカニズムはいまだ不明な点が多い。
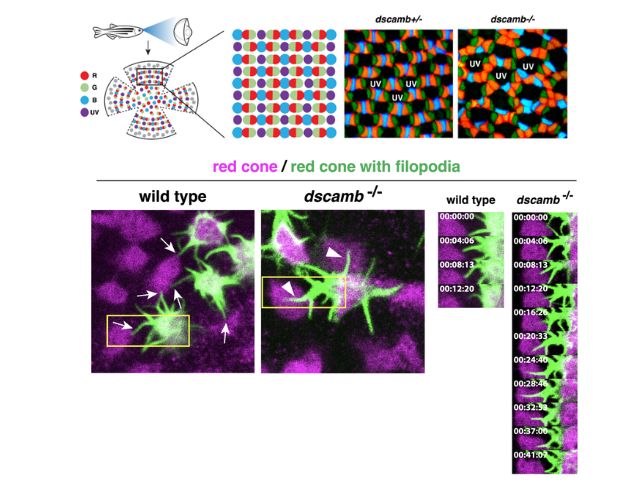
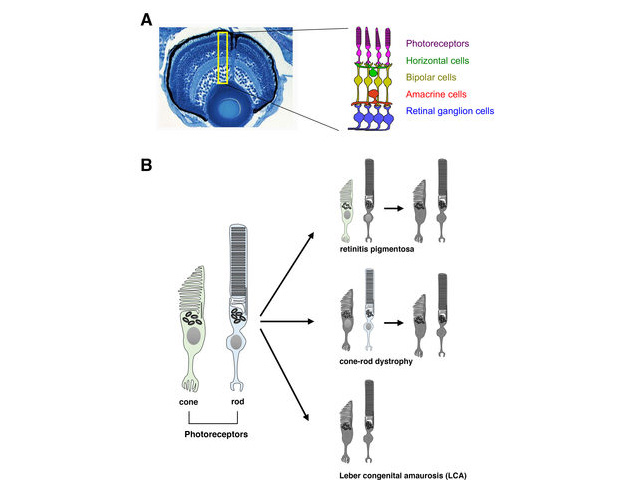
LCAでは網膜の機能が影響を受けることがわかっている。健全な網膜には,錐体および桿体と呼ばれる光を感知する2種類の光受容細胞がある。錐体は明るい環境において色覚をつかさどり,一方,桿体は薄暗い環境で明暗視を担う。LCA患者の場合,錐体と桿体の形態異常や欠損を引き起こすため,光を感知できなくなる。これまでAipl1など計24の遺伝子が,ヒトやマウスのLCAと関連することが明らかにされてきた。
研究グループは,胚期において視覚反応を示さなかったゼブラフィッシュ突然変異体であるgold rush(gosh)に着目し,研究を行なった。ゼブラフィッシュのゲノムでは,Aipl1aとAipl1bと呼ばれる2つのAipl1遺伝子が存在し,それぞれ桿体と錐体で機能していることがわかった。
さらに,gosh突然変異体では,Aipl1b遺伝子に突然変異が起きており,錐体においてAipl1の機能活性が失われていることが明らかになった。その結果,錐体が形態異常を示し,さらに進行性の細胞変性が起きることが観察された。一方,桿体には影響がなく,細胞変性は錐体にのみ限局することが示唆された。
また,Aipl1がcGMPホスホジエステラーゼ6とグアニル酸シクラーゼという2つの酵素の安定性に不可欠であることも突き止めた。これらの酵素は,視細胞内で光刺激を電気信号に変換する光受容機構と呼ばれる過程を仲介する。これらの酵素がないと,光刺激の情報が視細胞で伝達されず,視神経を通して脳へ視覚情報が伝わらないため,ゼブラフィッシュは光刺激に反応できなくなる。
この研究により,ゼブラフィッシュにおいてAipl1b遺伝子が視覚機能と錐体の維持に重要であることが示唆された。この遺伝子が欠損すると,錐体は光刺激を感知できず発生段階で変性してしまう。これらの知見はヒトのLCA治療法を開発する糸口となるとしている。