5. 超解像振動分光イメージング
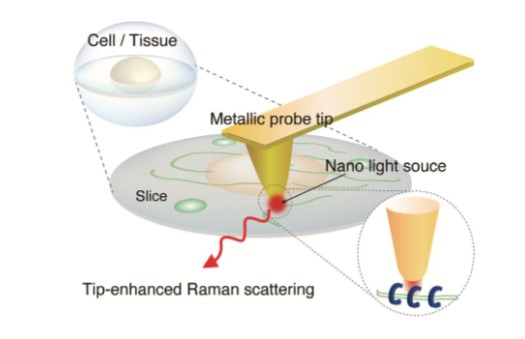
光の回折限界を超越した空間分解能で分光イメージングをおこなう手法は,組織切片内の微小な病変箇所の特定などに有効である。上記の金属ナノ構造を用いたラマン分光法を応用すると,バイオイメージング分析が可能となる。この場合,基板上に固定した金属ナノ構造を用いるのではなく,走査型プローブ顕微鏡のプローブ探針を金属コートしたものを用いる。金属ナノ探針先端に誘起される光増強場をナノ光源として用い,試料表面上を2次元走査することによって,ナノラマン分光イメージングが可能となる(図4)。この手法は探針増強ラマン分光法と呼ばれ,筆者らはこれまでに,カーボンナノチューブや二次元原子層材料のナノ分光分析に応用してきた5)。現在は,基礎医学研究者と共同で,生体材料や細胞などのナノラマン分光イメージング分析に取り組んでいる。
ラマン散乱と相補的な情報を与える赤外吸収も,バイオメディカルイメージング分析への応用が精力的に行われている。一般的な赤外顕微鏡の空間分解能は5μm程度に制限されるが,試料が赤外光(ポンプ光)を吸収した際の微小な熱膨張や屈折率変化を,可視光(プローブ)光を使って検出すると,サブミクロンの空間分解能で赤外吸収分光が可能となる。この顕微鏡は中赤外フォトサーマル(Mid-Infrared Photothermal:MIP)顕微鏡と呼ばれ,国内では東大の井手口らのグループが先進的な研究をおこなっている。筆者らは,MIP顕微鏡を独自に構築し,薬剤,生体組織切片,歯科材料などのイメージング分析をおこなっている6, 7)。
6. 高屈折率誘電体を用いた高感度センシング
シリコン(Si)などの高屈折率誘電体からなるナノ構造も,金属ナノ構造と同様に光増強効果が期待できるため,高感度バイオセンシングへの応用が期待されている。高屈折率誘電体ナノ構造は,可視域において電気・磁気多極子の光共鳴(Mie共鳴)モードが励起されるため,金属ナノ構造にはない特異な光共鳴体を示す。これらは金属ナノ構造に代わる光共鳴として近年注目を集め,国内でも「ミートロニクス(Mie-tronics)」を冠したシンポジウムが企画されている8)。
筆者らは,誘電体ナノ構造を用いた高感度蛍光バイオセンシング法の開発を行っている。誘電体表面では蛍光消光効果が抑制されるため,金属ナノ粒子のように表面にスペーサーを設ける必要がない。蛍光分子を電場増強度が高い誘電体表面まで近接させることができるため,高い蛍光増強効果が期待できる。最近では,誘電体ナノ構造基板を開発し,生体組織表面の蛍光増強センシング・イメージングへの応用を図っている。
さらに筆者らは,Siで構成される誘電体メタマテリアルを考案し,赤外分光センシングの高感度化を図っている(図5)9)。このSiメタマテリアルは特定の中赤外波長で完全反射する特性を有しており,その赤外波長を吸収する分子が近接すると,分子とメタマテリアル間の強い近接場相互作用によって赤外反射強度が劇的に減少する。この反射強度を測定することによって,高感度赤外吸収分光センシングが可能となる。誘電体メタマテリアル(完全反射体)は,金属製のプラズモニックメタマテリアル(完全吸収体)とは異なり,共鳴幅が分子振動モードの吸収幅と同程度であるため,特定の分子振動モードを選択的に検出可能である。検体分子の分子振動モードに対応させてSiメタマテリルの構造を調整すると,分光器を用いずに,分子選択的な分光センシングが実現される。筆者らは,高屈折率誘電体メタマテリアルを用いて揮発性有機化合物を高感度検出する手法を開発しており,呼気診断への応用を推進中である。