3. 消光効果を抑制した高感度蛍光センシングプローブ
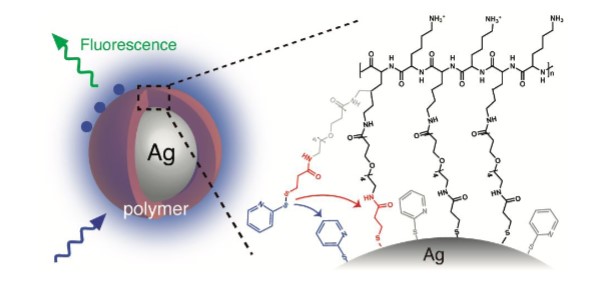
金属ナノ粒子を用いた蛍光分光は,局在表面プラズモンによる電場増強効果によって標識分子の蛍光強度を増強できるため,高感度光バイオセンシング技術として注目を集めている。蛍光分子が金属表面に近接すると,電場増強効果が増大する一方で,金属表面のエネルギー移動によって消光効果が支配的に作用する。したがって,金属表面に数nm程度のスペーサー膜を形成することによって,消光効果を抑制しながら高い電場増強効果を得ることができ,それにともなって高い蛍光増強効果が期待できる。消光抑制用のスペーサーとしてシリカが用いられる場合が多いが,10nm以下精度で膜厚を制御することは難しいのが現状である。
筆者らは,分子修飾性が高い高分子をスペーサーとして用いることを提案し,金属ナノ粒子表面に安定的に被膜する手法を開発した3)。高分子被膜金属ナノ粒子は,架橋剤を修飾した高分子を金属ナノ粒子溶液に添加することによってワンポットで作製された。図2に示すように,架橋剤に含まれるジスルフィド基が金属表面でチオール基に還元され,チオール基が金属表面と共有結合を形成することによって,銀ナノ粒子表面が化学的に高分子被膜された。高分子の末端官能基はアミノ基であるため,分子修飾性に優れており,実用性が高いのが特徴である。高分子膜の厚さは3nm程度で,プラズモニック蛍光増強に十分な薄さであり,同時に蛍光の消光を効果的に抑制する厚みも保たれている。その結果,30-40倍程度の高い蛍光増強が実現された。抗原抗体反応時に高分子被膜金属ナノ粒子が凝集した際に,ナノ粒子間に誘起されるギャップモードプラズモンを活用すれば,蛍光増強度がさらに1桁以上向上するため,高感度蛍光バイオセンシングへの応用が可能である。
4. 単一生体分子のラマン分光センシング
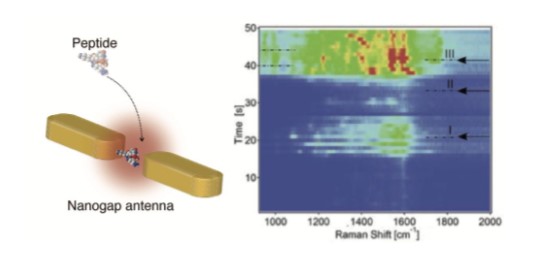
ラマン分光法は,無染色で生体分子を同定・検出することができるため,高分析能なバイオセンシング手法として有用である。ラマン散乱の断面積は蛍光のそれと比べて10桁以上小さいため,微弱なラマン散乱光をプラズモニックな金属ナノ構造を利用して増強して検出する必要がある。この手法は表面増強ラマン分光として知られており,ラマン増強能が高い金属ナノ構造の設計・作製が重要となる。筆者らは,ナノギャップアンテナ型の金属ナノ構造を設計・作製し,単一生体分子(ペプチド)のラマン散乱光を検出することに成功している(図3)4)。金属ナノ構造によって増強されたラマン散乱は分子の構造のみならず分子配向にも鋭敏であるため,ラマンスペクトルの時間変化を解析することによって,ペプチド分子が回転していることがわかった。生体分子のダイナミクスは抗原抗体反応機構とも相関があるため,基礎医学と臨床医学の両観点からも,このような生体ダイナミクスを一分子スケールで解析することは大変意義深い。