3. メタ表面バイオセンサー
蛍光増強に優れるメタ表面基板をバイオセンサーに利活用するためには,相応の準備を必要とした。まず,バイオ分子を効率的に固定しなければならない。このためにマイクロ流路系一式を導入した。ポリジメチルシロキサン(PDMS)製の流路チップとそれをメタ表面上に固定接合するホルダー,液流制御系が最低限必要である。図5(a)はPDMS流路チップとメタ表面基板を接合した分子検出チップをホルダーに装着して,試薬を流す配置を示している。独立な3チャンネルのin/outがある。
チャンネル数は制御系の口数に合わせており,制御口数を増やせばチャンネル数も増やすことができる。試薬はマイクロチューブに用意されており,白い矢印の方向に流れる。図5(b)は分子検出チップのホルダー内の様子を示す写真である。検出チップが外枠によってホルダー内で位置決めされ,マイクロ流路への出入り口と外部送液チューブの接続口の位置が常に合うように設計されている。
これまでに行ったバイオ分子検出実験の一例について述べる。図6(a)は典型的な抗体であるイミュノグロブリンG(IgG)をシリコンナノロッドアレイからなるメタ表面に固定した配置模式図である。多種多様にある抗体の大多数はIgG型の2重鎖,2軽鎖のY字型構造をもつ。実験手順として,まず,メタ表面上にIgG捕捉分子を固定した。捕捉分子液をリン酸緩衝液バッファー(PBS)でリンスした後,蛍光ラベル付きのヤギIgG分子を流し,捕捉分子で捕捉,固定した様子が図6(a)である。蛍光ラベル付きIgG分子液を再びPBSでリンスして,固定されていない分子を除き,流路内に乾燥窒素を流して乾燥した状態で蛍光測定を行った。
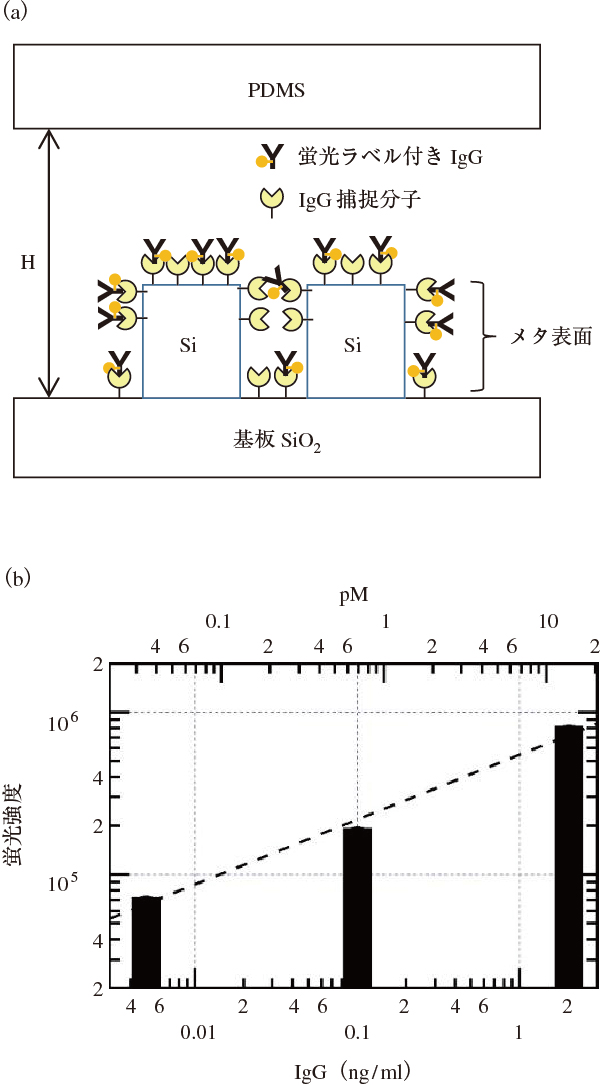
蛍光測定配置はPDMSチップ側から励起光(波長532 nm)を照射して,PDMSチップを通って放射される蛍光を検出する配置をとった。励起波長に対応して,蛍光分子は励起帯ピークが540 nm付近,発光ピークが560 nm付近にあるものから選択した。メタ表面の蛍光増強波長が570 nmから590 nmに来るように構造パラメータを合わせた(周期300 nm,円形ナノロッド直径236 nm,SOI高さ200 nm)。
集光した蛍光は分光器を通して,CCD検出器で蛍光スペクトルを取得した。蛍光強度は蛍光スペクトルの内,共鳴増強される波長範囲を積分することで算出した。蛍光強度をIgG濃度に対して,両対数プロットしたのが,図6(b)である。下軸が単位ng/ml,上軸が単位pMである。点線は0.4乗のべき乗を表しており,0.005 ng/ml(=5 pg/ml)すなわち0.03 pM(=30 fM)の極低濃度においても,まだスケールに乗っている。
この例における定量検出範囲の下限は30 fMということになる。さらに低濃度域は未だ測っていないが,すでにかなり高感度な分子検出ができていることが分かる。測定は数十万回で統計をとるなどの特段の工夫を行っていない段階で,これだけ高感度である稀なケースと言える。
市販キットのエライザ法では,約1 pMが最良値と認識されており2),30倍ほど高感度化がすでに実現している。エライザ法は工程の手数が多く,2〜6時間の作業時間がかかることを常々難点として挙げられているが,今回の蛍光検出は30分以下での対象分子固定によって行うことができる。
上述のIgG分子検出に加えて,癌マーカー分子であるp53抗体をサブpMの極低濃度検出にも成功している22)。様々な疾患診断の基準値は,低いものでpg/mlオーダーに設定されることが多く,メタ表面を使った蛍光検出法は医療診断への適用が可能な検出法である。これから,検出対象をさらに拡大していきたいと考えている。
今回紹介した蛍光検出法は,コアな検出性能の実証という基礎段階をクリアして,開発の初期段階をようやく脱しようとしている。技術的に完全に完成したものではないが,改良や拡張の方向性は見えている。これから検出装置としての開発に移行しようという段階にあり,今後,バイオ関連の研究機関や企業との連携が,一層重要になってくると認識している。








































