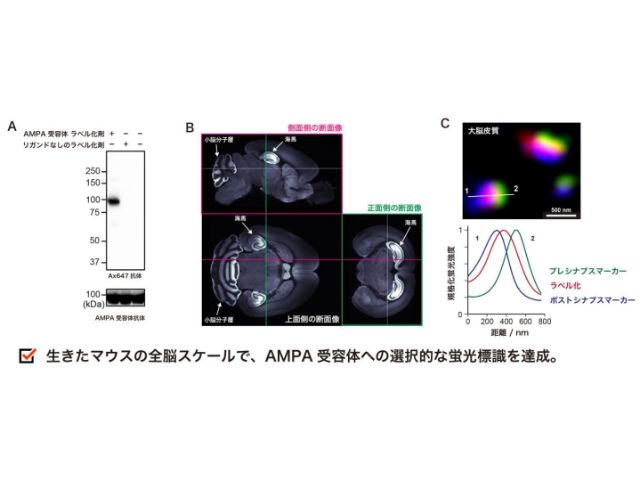
京都大学の研究グループは,神経伝達物質受容体の周辺に存在するタンパク質を生きたマウスの脳内で網羅的に標識(ラベリング)し,同定する新手法を開発した(ニュースリリース)。
神経伝達物質受容体のタンパク質間相互作用ネットワーク(インタラクトーム)の解明は,記憶,学習といった複雑な脳機能を理解する上で重要な課題となっている。
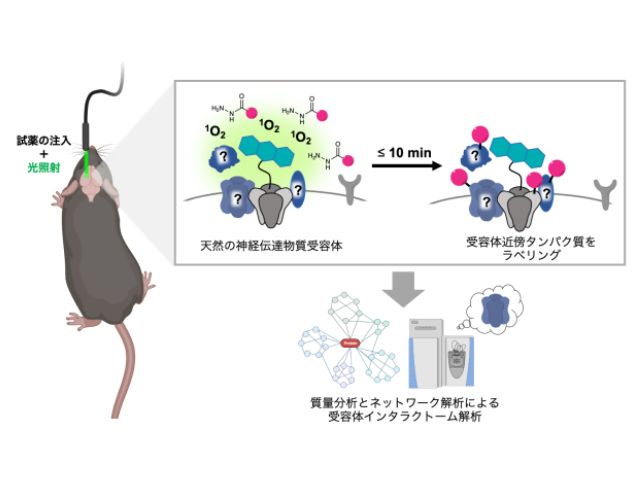
今回,研究グループは,時空間分解能に優れた光を駆動力とした新たな近傍ラベリング法としてPhoxID法を開発し,高い時空間分解能で生きたマウス脳内の受容体インタラクトームを同定することに成功した。
この手法ではまず,研究グループが長年開発してきた独自のタンパク質化学修飾技術を用いて,生きたマウス脳内の標的受容体に光増感剤を修飾する。その後,光ファイバーを用いて脳内に緑色光(520nm)を照射し一重項酸素(1O2)を発生させ,周辺タンパク質を酸化する。
この酸化タンパク質をヒドラジド連結デスチオビオチン標識剤によって修飾し,質量分析することで,受容体インタラクトームを網羅的に同定することが可能となる。
実際にこの手法をマウス脳内海馬領域のAMPARおよびGABAA受容体(GABAAR)を対象に適用したところ,わずか1–10 分の光照射で,既知相互作用タンパク質を含む複数の受容体インタラクトームの同定に成功した。
また,光照射部位を小脳に変更して同様の実験を行なうと,既知の小脳特異的AMPAR相互作用タンパク質が検出された。このことから,この手法は様々な脳領域に適用可能であることがわかった。
研究グループは,この手法の高い時間分解能を活用し,マウスの生後発達期から成熟期にかけて,シナプス形成に重要なAMPA受容体(AMPAR)の周辺タンパク質群が変化することを見出し,幼若期特異的にAMPARの周辺に存在する複数のタンパク質を発見した。
研究グループは,この技術は原理上あらゆるタンパク質を標的とした近傍タンパク質解析に適用可能であり,脳機能を分子レベルで解析するための強力な研究ツールとしての発展が期待されるとしている。