 大阪公立大学の研究グループは,がん治療に有用な生物機能性分子を細胞内導入する際の光誘導加速に関する新技術の基礎を構築した(ニュースリリース)。
大阪公立大学の研究グループは,がん治療に有用な生物機能性分子を細胞内導入する際の光誘導加速に関する新技術の基礎を構築した(ニュースリリース)。
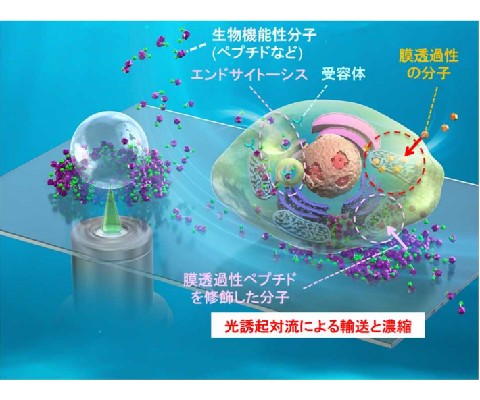
特定の細胞内小器官に生物機能性分子を到達させるためには細胞膜透過が不可欠であり,がん細胞を細胞死の一種であるアポトーシスなどで死滅させるためにも細胞膜透過の効率を向上させる必要がある。
従来の細胞内取込にはさまざまなプロセスがあるが,いずれも数μmol/L~数十μmol/Lと高濃度の生物機能性分子が必要であり,また低い細胞膜透過性のために狙った細胞内小器官に生物機能性分子を到達する確率が低く,薬物活性が低いことが問題視されている。
現在行なわれている細胞膜透過性を高める研究開発でも,細胞膜を通過するためには,数十μmol/L程度のペプチド濃度が必要。加えて,副作用を避けるために狙った細胞のみへ高効率に投与する技術構築が必要なため,低濃度の薬剤を狙った病原細胞に選択的に導入する技術の開発が切望されていた。
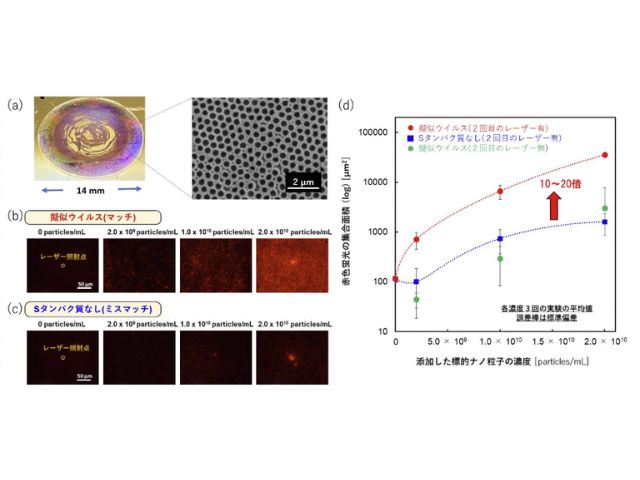
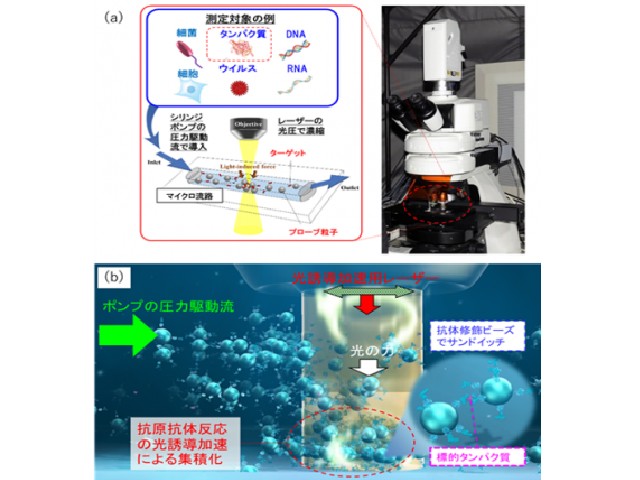
研究では,超放射の補助による光誘起対流を用いて,細胞透過性ペプチド(CPP)を含む生体機能性分子の細胞膜への集積と透過性向上を実現し,1/1000程度のnmol/Lレベルでの光誘起集合のドラッグデリバリーシステムへの応用を実証した。
細胞培養液中の生細胞の周りに光発熱集合を誘起するために,プラズモニック超放射を示す高密度に金ナノ粒子を固定したガラスボトムディッシュ,または金薄膜をコーティングしたガラスボトムディッシュに,生体にほとんど吸収されずダメージを与えない波長1064nmの赤外レーザー(出力:100mW~400mW)を10倍対物レンズで100秒間集光し,基板上の細胞から100μmほど離れた位置の生細胞付近に分子を濃縮した。
細胞内小器官であるミトコンドリアだけを染色する低分子を用いた実験では,従来の自然の細胞内導入では500nmol/L以上必要であり,レーザー照射点から離れた場所での比較実験結果から,1/100に相当する5nmol/Lや1/1000に相当する500pmol/Lのように低濃度ではほとんど細胞内に入らず,ミトコンドリアを染色できなかった。
一方でレーザー照射点付近の実験結果では,わずか1/1000の濃度である500pmol/Lでも光誘起バブル近傍の細胞内のミトコンドリアだけを選択的に染色できた。さらに,光誘導加速により従来法の1/100の濃度に相当する50nmol/LのR8-PADで,アポトーシスへの誘導による狙ったがん細胞の破壊に成功した。
研究グループはこの成果が,新薬の細胞試験で薬剤量の削減による副作用低減の知見獲得の低コスト化や,創薬プロセスの加速につながるとしている。