 京都大学と大阪大学は,光が神経活動を抑制する低分子量Gタンパク質3Gemを誘導し,これが体内時計の細胞の活動を抑制し,過剰に動くことを防いでいることを明らかにした(ニュースリリース)。
京都大学と大阪大学は,光が神経活動を抑制する低分子量Gタンパク質3Gemを誘導し,これが体内時計の細胞の活動を抑制し,過剰に動くことを防いでいることを明らかにした(ニュースリリース)。
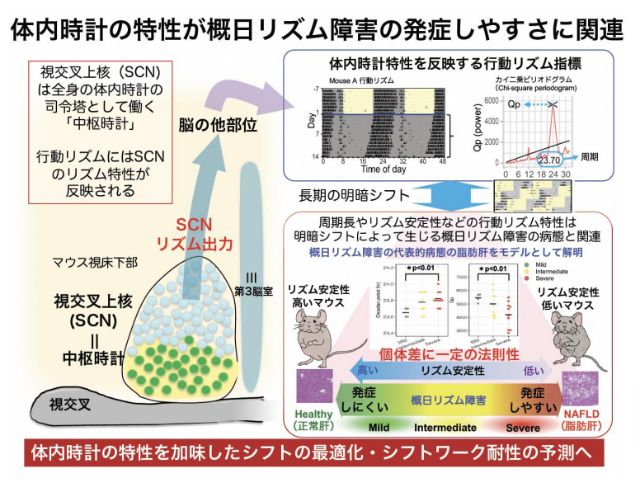
体内時計には,約24時間周期のサーカディアンリズムを生み出す仕組みだけでなく,このリズムのタイミングを環境の明暗変動に一致させるシステム(同調機構)がある。
これは,眼で受けた光の明暗情報が視神経から体内時計中枢である視交叉上核に伝達され,この時刻を動かすことで行なわれる。哺乳類では,時刻を一度に3時間以上動かすことはできないことが知られている。しかし,その制限が作られる仕組みについては分かっていなかった。
研究グループは,体内時計の中枢である視交叉上核の機能を探りたいと考え,時刻特異的に視交叉上核に発現する遺伝子を網羅的に探索し,朝に出現し夕方には消えてしまう低分子Gタンパク質Gemを見つけた。
Gemの役割を調べるため,夜間に光照射をすると,照射前には全くなかったGemが,照射後30分で上昇し始め,照射後60分から90分で劇的に増加した(昼間のピークの5倍以上),体内時計の昼間に光が当たっても増えないが,夜間には光刺激依存性のGem遺伝子の増加が確認された。
次に,Gemの機能を調べるため,遺伝子欠損マウスを作製し,実際の光刺激による行動リズムのシフト量を測ると,Gemを欠損させたマウスでは,野生型の正常マウスより,光刺激による時刻のシフト量が増大した。また,シフトの量は,光刺激が強いほど大きくなるという用量依存性を示すが,どの光の刺激量でも,常にGem欠損マウスでは大きく位相シフトした。
体内時刻のシフトは時計遺伝子が司っている。この時計のシフト量を,時計遺伝子の発現量として直接モニターできる視交叉上核の培養系を用いたリアルタイムモニター系でも調べたところ,シフト量はGem欠損マウスの視交叉上核では増大した。
膜電位固定法でGem欠損マウスのカルシウムイオンの変動を測定したところ,L型カルシウムチャネルを介したカルシウムイオンの細胞内への流入(カルシウム電流)が増大していた。
まとめると,次の2点を発見した。
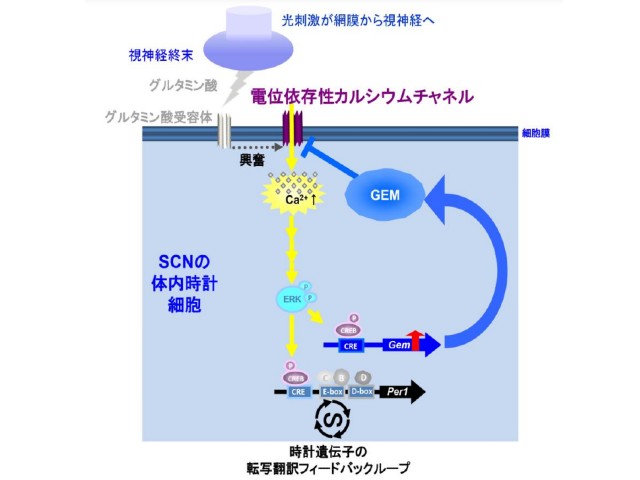
①光刺激に反応して,時計細胞にカルシウムチャネルの抑制物質であるGemが誘導される。
②誘導されたGemは,光刺激で時計細胞に発現したGemが,細胞が興奮するときに開く電位依存性カルシウムチャネル(VDCC)からのカルシウムイオンの細胞内への流入を抑制し,体内時刻が過剰にシフトしないように調節している。
研究グループは,今回の成果によって,VDCC阻害剤が各種脳疾患の新しい治療剤として活用できる可能性が広がるかもしれないとしている。