 名古屋大学の研究グループは,免疫チェックポイント分子PD-L1をターゲットとし,癌免疫により効果を高めた近赤外光線免疫療法の応用開発に成功した(ニュースリリース)。
名古屋大学の研究グループは,免疫チェックポイント分子PD-L1をターゲットとし,癌免疫により効果を高めた近赤外光線免疫療法の応用開発に成功した(ニュースリリース)。
免疫チェックポイント分子であるPD-1のリガンドであるPD-L1は,様々な固形癌で検出され,PD-1/PD-L1をターゲットとした免疫チェックポイント阻害薬は,様々な臓器の癌において有効性が示されている。
また,腫瘍のPD-L1の発現量が少なくても(TPS(Tumor Proportion Score)が≧1%),1次治療として利用でき,一定の効果があることが知られている。しかしながらその効果は充分ではなく,免疫チェックポイント阻害薬の効果を増強できる技術開発が求められている。
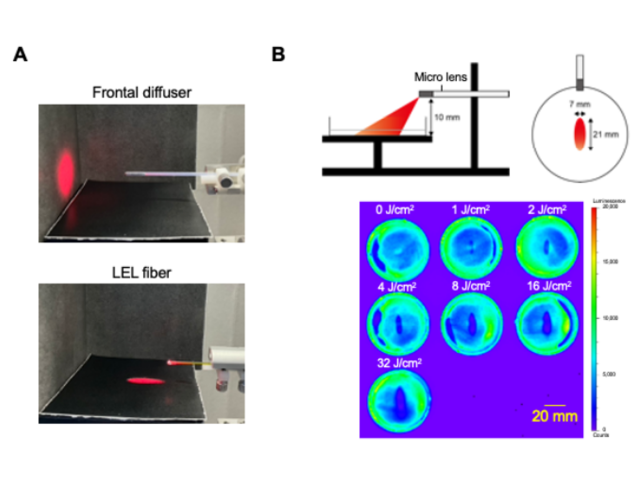
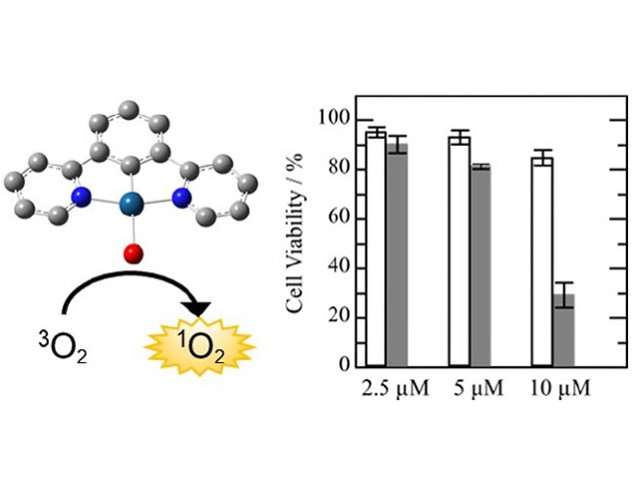
近赤外光免疫療法は,2011年に報告された新しい癌治療法。癌細胞が発現するタンパク質を特異的に認識する抗体と光感受性物質IR700の複合体を合成し,細胞表面の標的タンパク質に結合させた状態で690nm付近の近赤外光を照射すると,癌細胞が破壊される。
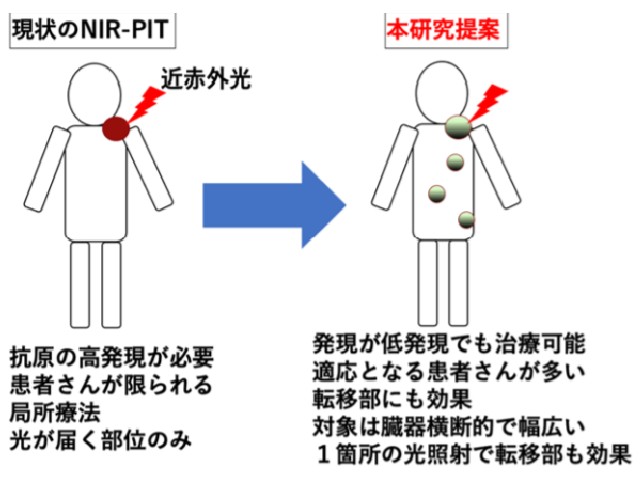
第5のがん治療として,期待される新規治療技術であり,2020年9月に世界に先駆けて日本でEGFRを高発現する再発既治療頭頸部がんに限定承認を受けて保険収載されている。今後の適応拡大にむけて,新規の標的を考慮する必要性があり,特にがん免疫療法との組み合わせは理想的であると考えられているという。
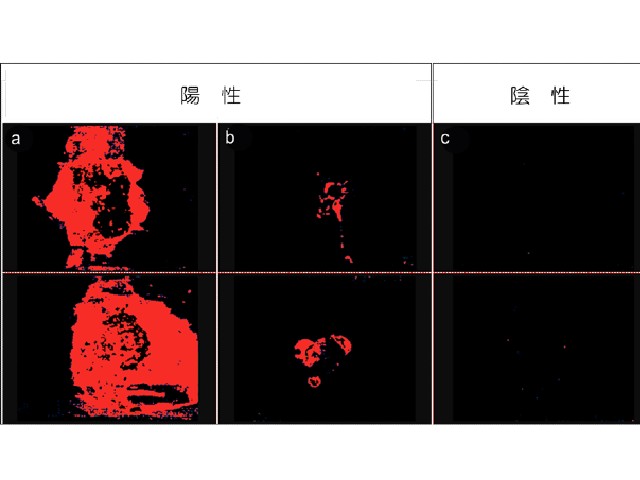
研究ではマウス抗PD-L1抗体をF(ab’)2化したものとIR700の複合体を合成し,細胞実験と動物実験においてPD-L1を標的として,腫瘍への近赤外光線免疫療法の効果を証明した。
PD−L1発現は人の場合と同様にマウス腫瘍でも限定的であるにも関わらず,癌免疫を活性化することで充分な抗腫瘍効果がえられたという。また転移部の腫瘍にも一定の効果が得られることがわかった(光アブスコパル効果)。
この治療は,従来の高発現の標的分子を対象とした近赤外光線免疫療法とは概念の異なる,がん免疫を応用した近赤外光線免疫療法と考えられ,適切な特異的がん抗原が高発現していない患者でも近赤外光線免疫療法の適応となりうることを示すもの。
研究グループは,代替治療としての近赤外光線免疫療法の提案として,臨床現場で将来的に使用できると期待されるとしている。