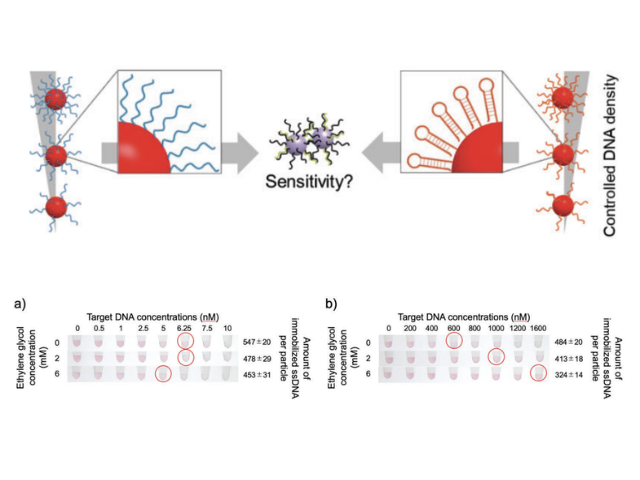
 大阪大学,名古屋大学,奈良先端科学技術大学院大学の研究グループは,ヒトのゲノムDNAを修復する酵素であるMRE11/RAD50/NBS1複合体(MRN)の高速原子間力顕微鏡観察に成功した(ニュースリリース)。
大阪大学,名古屋大学,奈良先端科学技術大学院大学の研究グループは,ヒトのゲノムDNAを修復する酵素であるMRE11/RAD50/NBS1複合体(MRN)の高速原子間力顕微鏡観察に成功した(ニュースリリース)。
細胞のゲノムDNAは遺伝情報を含んでいて,その塩基配列は細胞の働きを決める生命の設計図とも言える。このゲノムDNAが放射線や発がん物質などによって傷つけられると,遺伝情報が失われ細胞が癌化したり死んでしまったりする。それを防ぐために,傷ついたゲノムDNAを修復するための仕組みが細胞には備わっている。
この研究で対象としているヒトMRNは,特に放射線や活性酸素,発がん物質などによって引き起こされるゲノムDNAの切断を修復するメカニズムで重要な働きを担っている酵素となる。
例えば放射線治療では正常な細胞は少々ゲノムDNAが傷ついても死なないが,MRNの働きが弱くなっている細胞はゲノムDNAの傷を治せずに死んでしまう。また特に放射線などを当てなくてもDNAの切断は低頻度ながら起きるため,MRNは私たちが生きていく上で欠くことのできない必須の酵素となる。
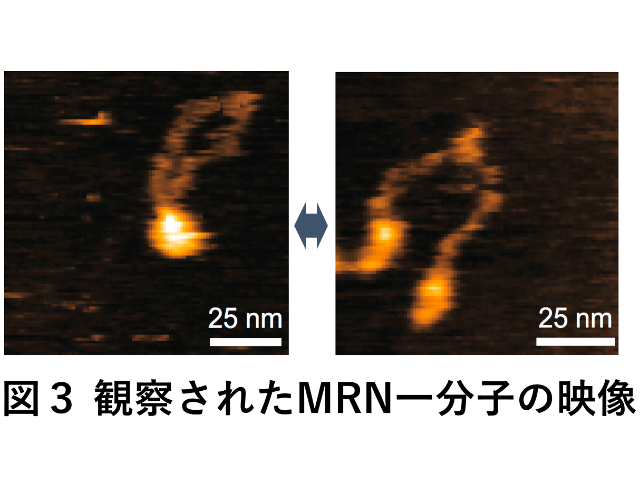
このように重要な酵素にもかかわらず,MRNがどのように切れてしまったDNAを直しているのかについては,実はよくわかっていなかった。その中でもMRN蛋白質分子の不思議なリング状の形状は,大きな謎の一つとされてきた。MRNはMRE11ヌクレアーゼ,RAD50,NBS1の三種類の蛋白質が各2個,全部で6個の蛋白質がリング構造を形成した複合体となる。
長年,このリング構造がフックと呼ばれる部位で開くことがDNAの傷を直す上で重要とされてきたが,この研究では定説とは逆側のヘッドと呼ばれる球状ドメイン側で開き,サクランボ構造となることがわかった。
さらにこの研究ではヒトのみならず酵母や大腸菌のMRNホモログの分子構造を調べ,新たに発見されたヘッド部位でのリング開閉運動が種を超えて保存されていることも見つけた。このことから,この動きがMRNの本質的な性質であることを示していると考えられるという。
さらにMRNのリング構造がフックでは開かないことを証明するため,生きた酵母細胞中のMRNのフックをSMCタンパク質と呼ばれる蛋白質のヒンジドメインと入れ替えたキメラMRNを持つ酵母がDNAの傷を直す力があることを示した。
このようにMRNはフックではなくヘッドでリングを開閉することが明らかになったことから,MRNはDNAを修復する際にリングの内側にDNAを包み込む形で結合する可能性が示された。
ヒトMRNはゲノムDNAを修復する酵素だがゲノム編集技術にも重要な酵素であり,今回の発見の医学・生物学的意義は大きいとしている。