東京大学らは,毎秒1,000細胞以上のスループットでラマン分光による分子指紋の測定が可能な,新しい大規模1細胞解析法を開発した(ニュースリリース)。
細胞は生物を構成する基本単位だが,人間の個体と同じように個々の細胞には個性がある。個々の細胞を区別して測定することで,集団平均の測定では見逃してしまう少数ながらも重要な細胞や,特定の細胞形質の発現に寄与している遺伝子の解析などといった重要な基礎科学的知見が得られる。
個々の細胞を高速に測定する方法として,フローサイトメトリーがある。通常,フローサイトメトリーでは,細胞内の特定の生体分子を蛍光色素で染色し,蛍光の有無を基準として細胞の解析を行なう。
しかしながら,蛍光染色を用いた方法では,蛍光色素による細胞毒性,細胞機能の変化や色素の退色,色数の制限,色素以外からの自家蛍光の影響,目的部位に結合していない色素からの背景信号といった欠点があり,また,代謝物質などの比較的小さな生体分子の染色が難しいことからその応用範囲に制限があった。
ラマン分光法は分子振動に起因する光の非弾性散乱を測定する分析手法で,光を当てるだけで細胞内の生体分子を染色せずに測定することが可能。しかし通常,ラマン散乱は蛍光に比べて信号強度が桁違いに弱く,一定時間内に測定できる細胞数には限りがあった(1秒間に1個程度)。
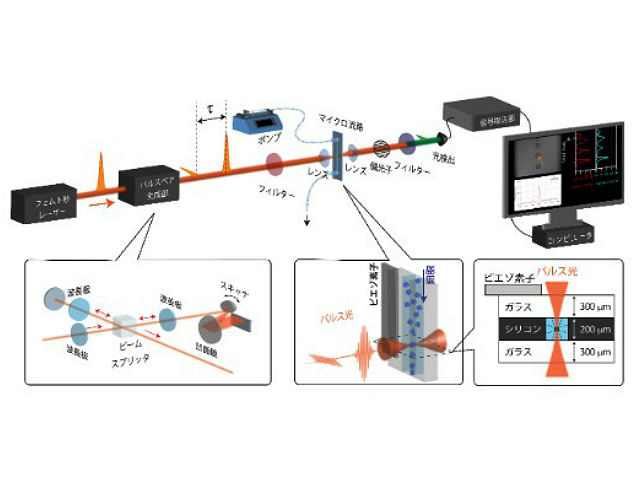
これまでに研究グループは,ラマン分光法を高速化するために,最先端のレーザー技術を駆使した高速フーリエ変換コヒーレント反ストークスラマン散乱分光法(FT-CARS法)を開発してきた。高速FT-CARS法を用いると,毎秒約24,000回もの広帯域ラマンスペクトルの測定が可能であるため,多数の細胞を生きたまま短時間のあいだに測定することが可能となる。
今回,研究グループは,高速FT-CARS法をマイクロ流体工学技術と組み合わせることで,マイクロ流路中に整列された状態で流れてくる多数の細胞を再現性良く測定することを可能にし,毎秒1,000以上の細胞の広帯域ラマン分光測定という従来法の1,000倍程度高いスループットを実現した。それにより個々の細胞中に存在する生体分子の量と構造を決定し、個々の細胞の個性に注目しつつ,多数の細胞を生きたまま解析する細胞解析が可能となったという。
研究グループは,蛍光標識を用いずに細胞形質の高速スクリーニングを可能にすることで,スマートセル産業への貢献やリキッドバイオプシーを用いた新しい診断法の開発への応用が期待できるとしている。