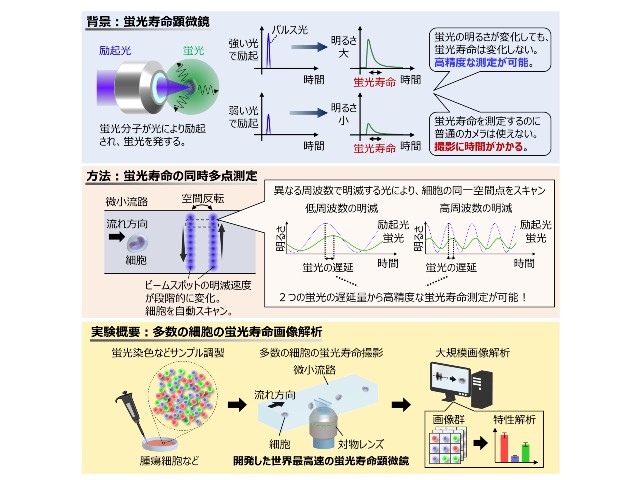
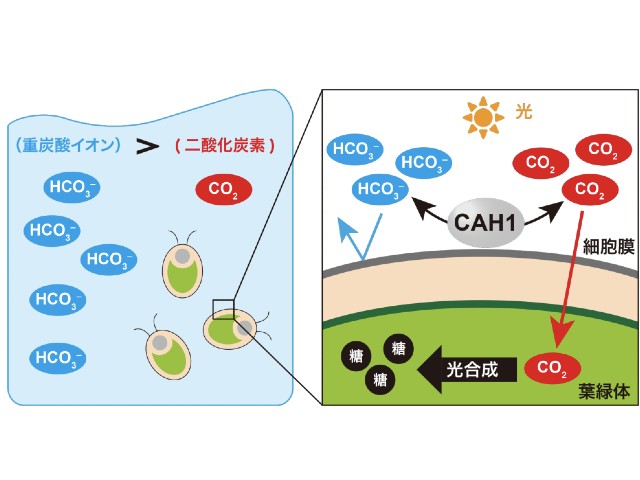
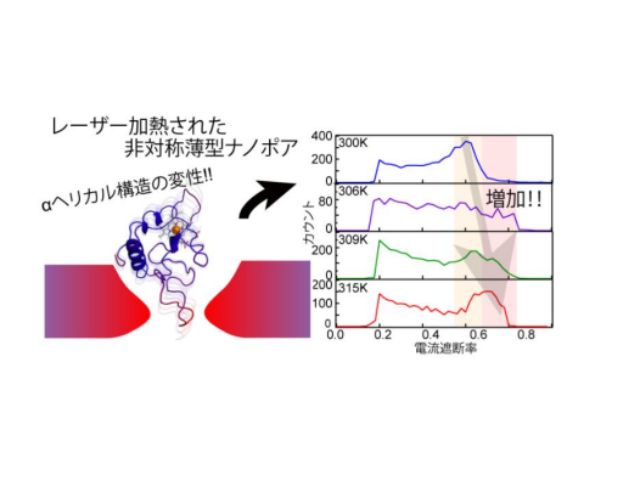
 東京大学の研究グループは,内閣府 総合科学技術・イノベーション会議が主導する革新的研究開発推進プログラム(ImPACT)「セレンディピティの計画的創出による新価値創造」の一環として,望みのタイミングで分子振動が起こらない化学構造から分子振動を起こす化学構造へ変化させる「スイッチオン」が可能な新しい生体分子検出法を開発した(ニュースリリース)。
東京大学の研究グループは,内閣府 総合科学技術・イノベーション会議が主導する革新的研究開発推進プログラム(ImPACT)「セレンディピティの計画的創出による新価値創造」の一環として,望みのタイミングで分子振動が起こらない化学構造から分子振動を起こす化学構造へ変化させる「スイッチオン」が可能な新しい生体分子検出法を開発した(ニュースリリース)。
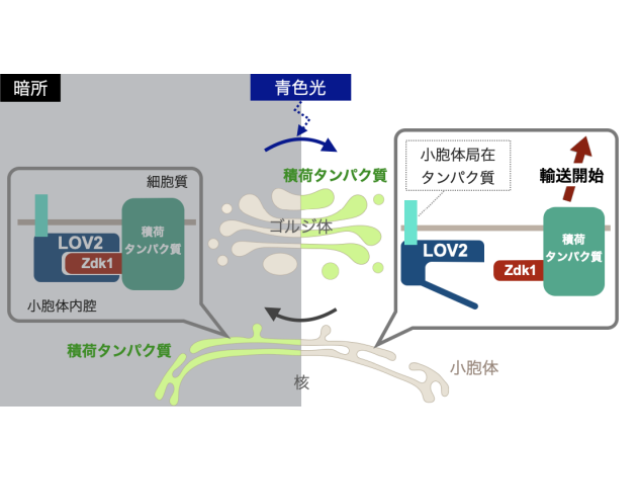
細胞膜上のコレステロール密度が高い「脂質ラフト」と呼ばれる場所には,さまざまな病気に関わるタンパク質が存在していることが知られており,その動きを詳しく調べる手法が求められている。また,近年,病気による生体内の酸性環境との関係も注目されている。
通常は,脂質ラフトのような細胞内構造を検出するために蛍光分子を目印とするが,コレステロールのような比較的小さな生体分子に大きな蛍光分子を結合させると,生体分子としての性質が大きく変わってしまう。
そこで,非常に小さなアルキン(炭素-炭素3重結合)を目印とし,アルキンが発するラマン散乱光を用いて検出する方法が注目されている。しかし,これまでは目印となるアルキンが常に検出されてしまい,特定部位,あるいは特定環境を区別して観察することはできなかった。
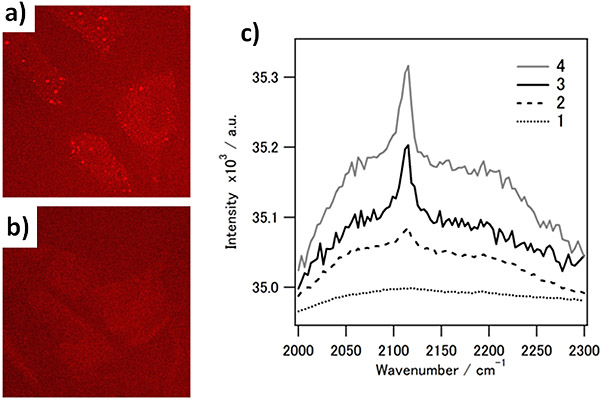
研究グループは,アルキンを目印とする新しいコレステロール類似体を開発し,望みのタイミングでスイッチオンできることを実証した。開発した分子を細胞内に取り込ませ,変換反応でスイッチオンにし,誘導ラマン散乱顕微鏡で観察したところ,弱酸性環境下にあるコレステロール類似体のみを可視化することに成功した。
このようなスイッチオン型のプローブは,特定の場所や条件における脂質ラフトの動きを選択的に追跡でき,腫瘍や炎症部位においてがん細胞や免疫細胞がどのように脂質ラフトを介してシグナル伝達や小胞輸送を制御しているかなど,病態の分子メカニズムを理解するための助けになると期待されるという。