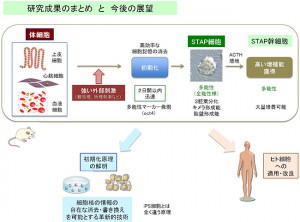
理化学研究所発生・再生科学総合研究センター細胞リプログラミング研究ユニット研究ユニットリーダーの小保方晴子氏を中心とする研究ユニットらは、動物の体細胞の分化の記憶を消去し、万能細胞(多能性細胞)へと初期化する原理を新たに発見し、それをもとに核移植や遺伝子導入などの従来の初期化法とは異なる「細胞外刺激による細胞ストレス」によって、短期間に効率よく万能細胞を試験管内で作成する方法を開発した。
哺乳類の発生過程では、着床直前の受精胚の中にある未分化な細胞は、体のすべての細胞に分化する能力(多能性)を有している。ところが、生後の体の細胞(体細胞)は、細胞の個性付け(分化)が既に運命づけられており、血液細胞は血液細胞、神経細胞は神経細胞などの一定の細胞種類の枠を保ち、それを越えて変化することは原則的にはない。即ち、いったん分化すると自分の分化型以外の細胞を生み出すことはできず、分化状態の記憶を強く保持することが知られている。
今回、共同研究グループは、マウスのリンパ球などの体細胞を用いて、こうした体細胞の分化型を保持している制御メカニズムが、強い細胞ストレス下では解除されることを見いだした。さらに、この解除により、体細胞は「初期化」され多能性細胞へと変化することを発見した。この多能性細胞は胎盤組織に分化する能力をも有し、ごく初期の受精胚に見られるような「全能性」に近い性質を持つ可能性が示唆された。この初期化現象は、遺伝子導入によるiPS細胞(人工多能性幹細胞)の樹立とは全く異質のもの。
共同研究グループは、この初期化現象を刺激惹起性多能性獲得(STAP)、初期化された細胞をSTAP細胞と名付けた。STAPの発見は、細胞の分化状態の記憶の消去や自在な書き換えを可能にする新技術の開発につながる画期的なブレイクスルーであり、今後、再生医学のみならず幅広い医学・生物学に貢献する細胞操作技術を生み出すと期待できる。
詳しくはこちら。