理化学研究所は,酵母において,糖鎖の結合(糖鎖修飾)を触媒する酵素「オリゴ糖転移酵素(OST)」が,本来のタンパク 質の糖鎖修飾を触媒する機能だけでなく,それとは逆の分解活性の触媒機能も持ち,遊離糖鎖を生成することを明らかにした。
糖鎖は,タンパク質や脂質などの生体分子に結合し,それら分子の性質を変化させたり,機能を付加するなど重要な役割を担っている。主に細胞小器官 の1つである小胞体の内腔でさまざまな糖鎖修飾が行なわれ,糖鎖の種類によってタンパク質の品質管理や細胞内輸送,細胞間コミュニケーションなど,さまざま な生命活動の制御に関与する。
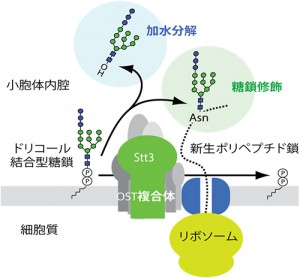
ヒトや酵母を含む多くの真核生物では,複数の膜タンパク質から構成されるOSTが糖鎖修飾を触媒する。その時,OSTは小胞体膜上に存在するドリコール脂質に構築された糖鎖(ドリコール結合型糖鎖)をひとまとめにタンパク質に結合させるユニークな性質を持つことが知られている。
正常な糖タンパク質は適切な場所へ輸送されるが,異常な糖タンパク質は細胞質に輸送される。そこで,糖鎖を切り離す酵素「ペプチド:N– グリカナーゼ(PNGase)」によって糖鎖が取り除かれ,細胞質には切り離された糖鎖(遊離糖鎖)が生成される。しかし,過去の研究から小胞体内腔に も遊離糖鎖が生成されることが知られており,その生成過程は長年不明のままだった。そこで,共同研究グループは,PNGaseに依存しない遊離糖鎖と OSTの関係性について,遺伝学および生化学的な手法を用いて検証を行なった。
OSTの触媒機能を低下させた変異酵母を作成して,遊離糖鎖の生成量を調べたところ,小胞体内の遊離糖鎖生成量が減少することが分かりった。さらに出芽酵母から精製したOSTとドリコール結合型糖鎖を混合し,試験管内で遊離糖鎖の生成反応を解析した。その結果,OSTとドリコール結合型糖鎖の両者が存在するときだけ遊離糖鎖が生成されることが分かった。これらの結果から,OSTはドリコール結合型糖鎖を分解して遊離糖鎖を生成することが明らかとなり,長年不明だった小胞体内の遊離糖鎖の生成機構の一端を解明できた。OSTの本来の機能はタンパク質の糖鎖修飾を適切に行うなことだが,その機能とは逆の分解反応も触媒することが明らかになった。
最近,OSTの触媒を担うタンパク質をつくる遺伝子の変異が,先天性糖鎖合成異常症と呼ばれる全身性の重篤な症状を呈する病気の原因となることが明 らかにされている。さらに知見を積み重ねることで,この病気の治療薬創出につながると期待できる。今後,OSTの糖鎖修飾活性と分解活性がどのように制御されているか,その分子機構の解明を目指す。
詳しくはこちら。