東京農工大学大学院・教授の三沢和彦氏(現・同大工学研究院長/工学府長/工学部長)の研究グループは,1台の超短パルスレーザーでデータ取得速度を大幅に高速化したコヒーレントラマン顕微鏡システムを開発した。
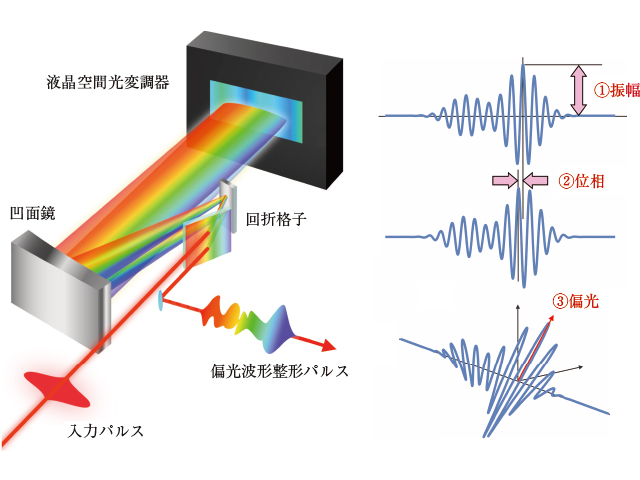
三沢氏の研究グループは,1台の超短パルスレーザーを用い,パルス光を回折格子と液晶空間光変調器からなる位相制御装置によって,1つのパルス内で周波数ごとに位相を操作する技術を開発(図1)し,分子固有の構造に由来する光散乱信号を顕微鏡下で高感度かつ簡便に測定可能な『位相制御コヒーレントラマン顕微分光法』と呼ぶ手法を確立した。
この分光法では,従来のコヒーレントラマン顕微鏡で必要だった複数のレーザーによるパルス光のタイミング同期が不要となり,光軸合わせが簡素化される。これによって,コヒーレントラマンが持つ高いS/N比信号と装置安定性を両立させた。三沢氏の研究グループではこの独自技術を活用し,東京医科歯科大学・教授の寺田純雄氏らと共同で医療分野への応用研究を行なってきた。2010年には生きたイカの神経細胞内に注入した麻酔ガスの分子を検出することに成功している。
三沢氏によると,「このときはまだ,神経細胞の中で小分子薬剤を検出する技術がなかった。研究では生体内で麻酔ガスが神経信号伝達をブロックする過程を分子レベルで解明することを目指し,小分子薬剤を感度よく追跡することが可能なレーザー分光技術の確立にチャレンジした」という。
また,2015年には,この手法を用いてマウスの眼球角膜に投与した低分子化合物の濃度分布測定にも成功しており,共同研究に参画するワイヤードが生体内薬剤イメージング装置として製品化している。
今回の成果は,ラベルフリーで小分子の濃度分布をイメージングできる顕微鏡システムを開発したことによるもので,単一ビーム方式のコヒーレントラマン顕微鏡としては,撮影速度をこれまでの200倍以上に高速化することに成功した。この開発は,日本医療研究開発機構(AMED)の先端計測分析技術・機器開発プログラムの一環で行なわれた。
三沢氏は,「医療分野において実用化を考えた場合,鮮明な画像取得が求められる」と語る。しかし,これまでの単一ビーム方式では,異なる分子を振動数の違いから区別するための性能となる周波数分解能を高くしようとすると,検出に用いるパルスの波長幅を狭くする必要があるが,検出パルスの波長幅を狭くした場合,ラマン信号が強く取れないため,周波数分解能と画像取得速度の性能を両立することが難しいという課題があった。
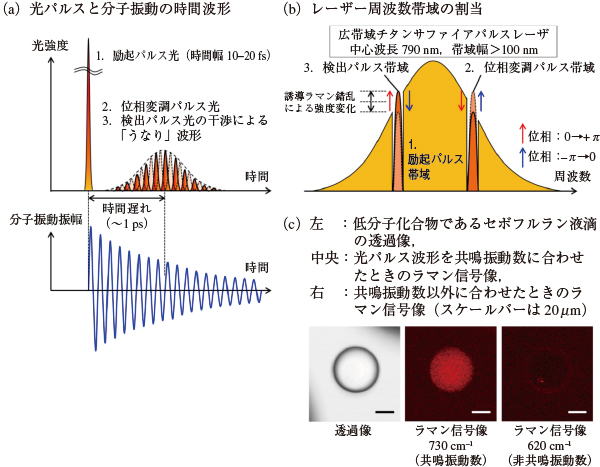
三沢氏の研究グループが新たに開発した顕微鏡システムは,これまで培ってきた位相制御装置による波形整形技術を駆使し,信号検出に用いる2つのパルスのうなりの周波数幅を狭くすることを可能にした(図2)。これにより,周波数分解能を保持したまま,200分の1以下の時間で画像データを取得できるようにした。
図2(c)は無色透明の低分子化合物である吸入麻酔薬(セボフルラン)の液滴を水中でイメージングした例だが,麻酔薬分子の共鳴振動数に合わせて光パルスのうなりの周波数を調整することで,麻酔薬だけをコントラストよく抽出して画像化することに成功している。この装置を用いて撮像すると,1つの画像の中の明るさの信号強度がそのまま化合物の濃度分布となるため,生体組織の外から与えた薬剤がどこにどれくらいの量だけ吸収されるのかを画像から解析することが可能になる。
当初の画像品質は2μmステップで,1ピクセルあたり68 msだったのに対して,最終的には0.5μmステップで,1ピクセルあたり0.1 msに上がっており,画素数では目標数値の100×100ピクセルに対して300×200ピクセルにまで高めた。この成果を発表した論文は,米国光学会が選ぶ注目論文に選出されている。
今後は臨床応用にフェーズを移すとしている。三沢氏は「例えば,患部に薬剤がどこまで入り込んでいるかというのをイメージングしたり,外科手術の際に切除してよい組織か残すべきものかをその場で判別したりするといった応用が期待できる。そこでは,ありのままをイメージングする技術が求められる。臨床応用においては染色ができない場面でイメージングする技術開発がトレンドになる」と語る。さらに,応用分野としてスキンケア分野を挙げており,「化粧品開発に関わる薬剤が皮膚に対してどこまで浸透しているかをダイレクトに見たいというニーズもある」(三沢氏)とし,医療分野のみならず,適用可能な市場は広がるものと考えられている。◇
(月刊OPTRONICS 2017年8月号掲載)