滋賀医科大学の研究グループは,全身で蛍光タンパク質を発現する遺伝子導入トランスジェニック(Tg)動物を,非ウイルス性の遺伝子導入手法の一つを用いて作出することに,非ヒト霊長類において世界で初めて成功した(ニュースリリース)。
小動物では病態を再現できないヒトの疾患において,非ヒト霊長類における研究は注目を集めていたが,新型コロナウイルス(COVID-19)の世界的な流行を経て,その重要性がより高まっている。
研究グループは,非ヒト霊長類の一つであるカニクイザルを用いた高度な発生工学が可能な世界でも数少ない研究施設の一つで,これまでに先端的な遺伝子改変技術を用いて,様々な疾患モデルザルの作出等を行ってきた。
しかし,非ヒト霊長類における遺伝子改変は未だ発展途上にある。CRISPR/Cas9技術の開発により,特定の遺伝子が欠損したノックアウト動物は非ヒト霊長類においても比較的容易に作出が可能となったが,外来遺伝子を強制発現したTg動物の作出については未だに効率が悪く,非ヒト霊長類ではレンチウイルスベクターなどのウイルスを用いた手法が必要となっている。
レンチウイルスベクター法により,カニクイザルにおいても外来遺伝子を強制発現したTg動物の作出が可能だが,特別な施設・機器・手技が必要,胚移植前の遺伝子改変胚の選抜が難しい場合がある,導入できる遺伝子のサイズに上限がある,等の欠点がある。
研究では,この欠点を克服するため,非ウイルス性の遺伝子導入手法の一つであるpiggyBacトランスポゾン法を用いて,Tg動物の作出を試みた。加えて,カニクイザルにこの手法を適用するにあたって最適化を行ない,新規の発生工学的手法を用いた。
その結果,全身で蛍光タンパク質を発現する非ヒト霊長類を,非ウイルス性の遺伝子導入手法を用いて作出することに世界で初めて成功した。
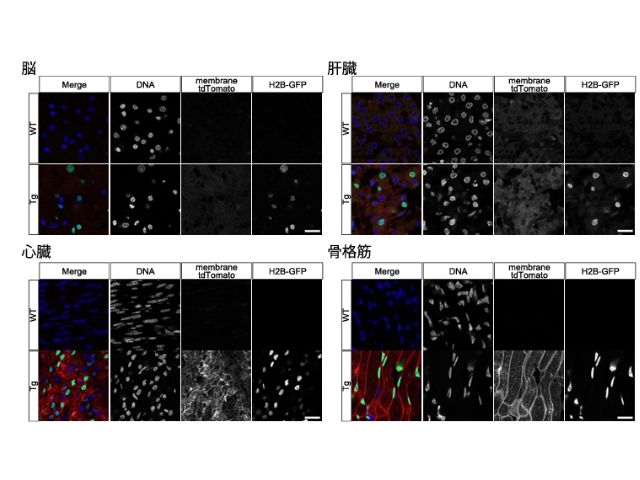
今回作出したTgカニクイザルは,全身の組織への遺伝子(膜局在型の赤色蛍光タンパク質,核局在型の緑色蛍光タンパク質)導入ならびに遺伝子発現が確認され,さらに生殖細胞における導入遺伝子の発現も確認された。
なお,遺伝子挿入位置解析の結果,遺伝子挿入パターンに大きな組織間の差は無かった一方,遺伝子発現のレベルは組織によって異なることが明らかとなったことから,発現させたい組織によって,適切なプロモーターを選択することが重要であることが示唆された。
研究グループは,今後,複数の遺伝子の同時発現・人為的発現制御など,より高度な設計を必要とする複雑な遺伝子改変が,非ヒト霊長類においても可能になることが期待されるとしている。